
Le Dr Kevin Tsia (1er à partir de la droite) et son équipe ont développé une nouvelle technologie d'imagerie optique pour rendre la microscopie à fluorescence 3D plus efficace et moins dommageable. (De gauche à droite :Dr Yuxuan Ren, Dr Queenie Lai et Dr Kevin Tsia) Crédit :@The University of Hong Kong
Les scientifiques utilisent la microscopie à fluorescence pour étudier le fonctionnement interne des cellules et des organismes biologiques depuis des décennies. Cependant, beaucoup de ces plates-formes sont souvent trop lentes pour suivre l'action biologique en 3D; et trop dommageable pour les spécimens biologiques vivants avec une forte illumination lumineuse.
Pour relever ces défis, une équipe de recherche dirigée par le Dr Kevin Tsia, Professeur agrégé du Département de génie électrique et électronique et directeur de programme du baccalauréat en génie biomédical de l'Université de Hong Kong (HKU), développé une nouvelle technologie d'imagerie optique - la microscopie à matrice de lumière codée (CLAM) - qui peut effectuer une imagerie 3D à grande vitesse, et est suffisamment économe en énergie et doux pour préserver les spécimens vivants pendant la numérisation à un niveau qui n'est pas atteint par les technologies existantes.
Cette technologie d'imagerie avancée a récemment été publiée dans Lumière :science et applications . Une demande de brevet américain a été déposée pour l'innovation.
« CLAM permet une imagerie par fluorescence 3D à une fréquence d'images élevée comparable à celle de la technologie de pointe (environ 10 volumes par seconde). Plus important encore, il est beaucoup plus économe en énergie, avoir plus de 1, 000 fois plus doux que les microscopes 3D standards largement utilisés dans les laboratoires scientifiques, ce qui réduit considérablement les dommages causés aux spécimens vivants lors de la numérisation, " a expliqué le Dr Tsia.
Les plateformes de microscopie biologique 3D existantes sont lentes car tout le volume de l'échantillon doit être scanné séquentiellement et imagé point par point, ligne par ligne ou plan par plan. Dans ces plateformes, un seul instantané 3-D nécessite un éclairage répété sur l'échantillon. Les spécimens sont souvent illuminés avec des milliers à des millions de fois plus d'intensité que celle de la lumière du soleil. Ceci est susceptible d'endommager le spécimen lui-même, n'est donc pas favorable à l'imagerie biologique à long terme pour diverses applications comme la science anatomique, biologie du développement et neurosciences.
De plus, ces plates-formes épuisent souvent rapidement le "budget" de fluorescence limité - une contrainte fondamentale selon laquelle la lumière fluorescente ne peut être générée que lors d'un éclairage pendant une période limitée avant qu'elle ne s'estompe de façon permanente dans un processus appelé "photo-blanchiment, " qui fixe une limite au nombre d'acquisitions d'images pouvant être effectuées sur un échantillon.

Microscopie à matrice de lumière codée (CLAM) Crédit :@The University of Hong Kong
"L'éclairage répété sur l'échantillon accélère non seulement le photo-blanchiment, mais génère également une lumière de fluorescence excessive qui ne forme finalement pas l'image finale. D'où, le « budget » de fluorescence est largement gaspillé dans ces plateformes d'imagerie, " ajouta le Dr Tsia.
Le cœur de CLAM transforme un seul faisceau laser en un réseau à haute densité de « feuilles lumineuses » à l'aide d'une paire de miroirs parallèles, pour s'étendre sur une grande surface de l'échantillon en tant qu'excitation de fluorescence.
"L'image dans l'ensemble du volume 3D est capturée simultanément (c'est-à-dire parallélisée), sans qu'il soit nécessaire de balayer l'échantillon point par point ou ligne par ligne ou plan par plan comme requis par d'autres techniques. Une telle parallélisation 3-D dans CLAM conduit à une imagerie de fluorescence 3-D très douce et efficace sans sacrifier la sensibilité et la vitesse, " comme l'a souligné le Dr Yuxuan Ren, un chercheur postdoctoral sur le travail. Le CLAM surpasse également les méthodes d'imagerie par fluorescence 3D courantes en réduisant l'effet du photo-blanchiment.
Pour préserver la résolution et la qualité de l'image dans CLAM, l'équipe s'est tournée vers le multiplexage par répartition en code (CDM), une technique de codage d'image largement utilisée dans les télécommunications pour envoyer plusieurs signaux simultanément.
"Cette technique d'encodage nous permet d'utiliser un capteur d'image 2D pour capturer et reconstruire numériquement toutes les piles d'images en 3D simultanément. Le CDM n'a jamais été utilisé dans l'imagerie 3D auparavant. Nous avons adopté la technologie, qui est devenu un succès, " expliqué par le Dr Queenie Lai, un autre chercheur postdoctoral qui a développé le système.
Comme démonstration de validation de principe, l'équipe a appliqué CLAM pour capturer des vidéos 3D d'un flux rapide de microparticules dans une puce microfluidique à un débit volumique de plus de 10 volumes par seconde comparable à une technologie de pointe.
Imagerie 3D à grande vitesse avec CLAM. Crédit :L'Université de Hong Kong
"CLAM n'a pas de limitation fondamentale dans la vitesse d'imagerie. La seule contrainte vient de la vitesse du détecteur utilisé dans le système, c'est-à-dire l'appareil photo pour prendre des instantanés. À mesure que la technologie des caméras à haute vitesse progresse continuellement, CLAM peut toujours repousser ses limites pour atteindre une vitesse de balayage encore plus élevée, " souligné par le Dr Jianglai Wu, la recherche postdoctorale qui a initié le travail.
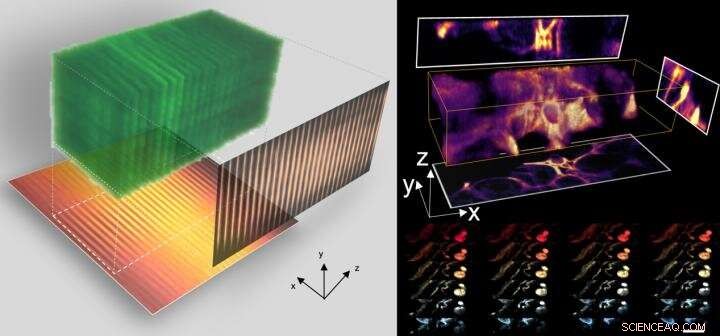
L'équipe a fait un pas de plus en combinant CLAM avec la nouvelle technologie d'épuration des tissus de la Faculté de médecine HKU LKS pour effectuer une visualisation 3D des glomérules de souris et de la vascularisation intestinale à une fréquence d'images élevée.
"Nous prévoyons que cette technique combinée peut être étendue à une enquête histopathologique 3-D à grande échelle d'échantillons biologiques d'archives, comme cartographier l'organisation cellulaire dans le cerveau pour la recherche en neurosciences », a déclaré le Dr Tsia.
« L'imagerie CLAM étant nettement plus douce que toutes les autres méthodes, il favorise uniquement la « surveillance » à long terme et continue des spécimens biologiques sous leur forme vivante. Cela pourrait potentiellement avoir un impact sur notre compréhension fondamentale de nombreux aspects de la biologie cellulaire, par exemple. suivre en permanence le développement d'un embryon animal jusqu'à sa forme adulte ; surveiller en temps réel comment les cellules/organismes sont infectés par des bactéries ou des virus ; pour voir comment les cellules cancéreuses sont tuées par les médicaments, et d'autres tâches difficiles irréalisables par les technologies existantes aujourd'hui, " ajouta le Dr Tsia.
CLAM peut être adapté à de nombreux systèmes de microscope actuels avec une modification matérielle ou logicielle minimale. Profitant de cela, l'équipe prévoit d'améliorer encore le système CLAM actuel pour la recherche en biologie cellulaire, biologie du développement animal et végétal.