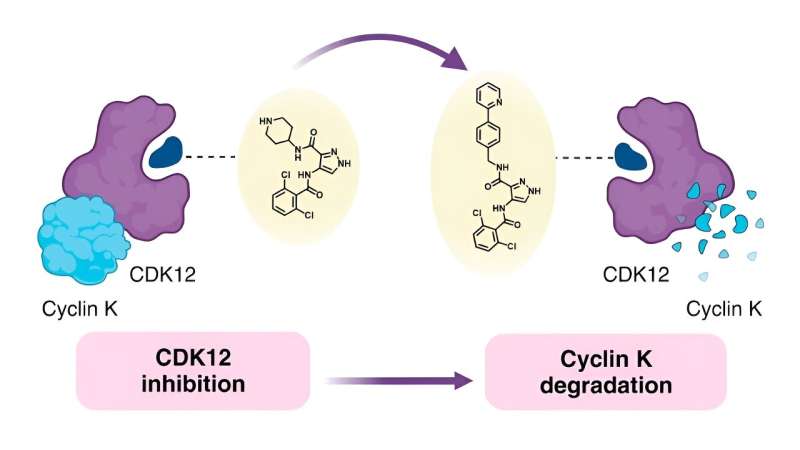
Les chercheurs ont découvert des moyens de convertir des médicaments anticancéreux ciblés de type inhibiteur en petites molécules appelées dégradants, qui aident à détruire les protéines favorisant le cancer dans les cellules.
Les scientifiques ont sélectionné des molécules connues pour inhiber certaines protéines, interrompant leur fonction, et les ont modifiées de diverses manières pour les convertir en dégradeurs de protéines, qui décomposent la protéine.
D'autres scientifiques peuvent désormais reproduire cette nouvelle approche pour développer et optimiser une gamme de dégradeurs de protéines. À long terme, cela pourrait contribuer à rendre les traitements anticancéreux existants plus efficaces et à créer de nouveaux traitements ciblant différentes protéines impliquées dans le cancer, y compris des protéines qui pouvaient auparavant être considérées comme « non médicamenteuses ».
La recherche, menée par des chercheurs de l'Institute of Cancer Research de Londres, est publiée dans ACS Chemical Biology. .
Les scientifiques du monde entier étudient la dégradation ciblée des protéines comme moyen d’éliminer des protéines spécifiques connues pour jouer un rôle dans le développement ou la progression du cancer. Les cellules décomposent naturellement les protéines endommagées ou inutiles, et il est possible de détourner ce processus en introduisant les bonnes molécules médicamenteuses afin que les cellules détruisent les protéines cancéreuses.
L'ICR s'engage à rechercher la dégradation ciblée des protéines comme moyen de découvrir de nouveaux traitements contre le cancer. En 2022, un don philanthropique majeur a permis d'ouvrir un nouveau Centre de Dégradation des Protéines au sein du Centre de Découverte des Médicaments contre le Cancer de l'ICR.
Les chercheurs ont déjà obtenu un certain succès en utilisant des chimères ciblant la protéolyse (PROTAC). Ceux-ci se lient à la fois à la protéine d’intérêt et à une enzyme appelée ubiquitine ligase E3 pour rapprocher les deux. L'enzyme marque ensuite la protéine avec l'ubiquitine, qui la marque pour sa destruction par la cellule.
Cependant, le poids moléculaire relativement élevé des PROTAC limite leur utilisation, car ils ne se dissolvent pas bien dans l’eau et peuvent avoir du mal à pénétrer dans les cellules à une concentration suffisamment élevée pour être efficaces. À l'inverse, si la concentration devient trop élevée, les PROTAC se lient tous à un seul des deux composés (l'enzyme ou la protéine cible) plutôt qu'aux deux, ce qui signifie que la dégradation des protéines est incomplète.
Une découverte plus récente a été l'utilisation de dégradants monovalents, souvent appelés colles moléculaires. Ceux-ci fonctionnent de la même manière que les PROTAC, mais ils modifient chimiquement la surface de l'enzyme ou de la protéine cible afin que les deux puissent se lier directement. Ces composés surmontent les limites des PROTAC car ils sont plus petits et toujours efficaces à des concentrations plus élevées.
Un médicament à base de colle moléculaire, découvert à la suite d'un programme de recherche à l'ICR, est déjà en phase préliminaire d'essais cliniques.
Voulant comprendre le lien entre la structure chimique des colles moléculaires et leur comportement – connu sous le nom de relation structure-activité (SAR) – les chercheurs à l’origine de la présente étude ont décidé d’utiliser un dégradant monovalent connu appelé CR8 comme point de départ. CR8 inhibe toutes les kinases dépendantes des cyclines (CDK), qui jouent de multiples rôles dans le développement des tumeurs, mais il dégrade également la protéine cycline K, qui favorise les voies de signalisation du cancer.
Des recherches antérieures ont montré que CR8 se lie à CDK12 et à un composant de la ligase E3 appelé protéine de liaison à l'ADN endommagée 1 (DDB1). Cela permet à la cellule de décomposer la cycline K liée à CDK12.
Forte de ces informations, l’équipe a tenté de remplacer la pyridine du CR8 par une large gamme de substituts. Ils ont d'abord essayé d'utiliser des groupes simples, notamment le fluor, le méthyle et l'hydroxy, avant de passer à des formations plus complexes pour déterminer comment ces changements affectaient la capacité de dégradation.
Dans la deuxième partie de l'étude, les chercheurs ont appliqué leur compréhension accrue du dégradeur SAR à d'autres inhibiteurs de CDK pour déterminer si leurs résultats étaient transférables. Ils ont découvert que les composants moléculaires qui induisaient la dégradation des protéines pouvaient être utilisés pour convertir plusieurs inhibiteurs différents en dégradeurs. Ils ont également identifié certains substituts qui ont conduit à une dégradation améliorée.
Première auteure Katie Thomas, titulaire d'un doctorat. étudiant à la Division de thérapie contre le cancer de l'ICR, a déclaré :« Il était surprenant de voir qu'un si large éventail de groupes pouvait être utilisé pour induire la dégradation de la cycline K. Cela signifie que l'interface d'interaction entre le dégradateur lié-CDK12 et DDB1 ne le fait pas. doivent être parfaitement optimisés pour que la dégradation se produise. C'est prometteur pour l'avenir de l'utilisation de colles monovalentes comme modalités thérapeutiques :cela nous aidera à faire progresser les molécules de la découverte à l'optimisation."
Les inhibiteurs de protéine kinase sont utilisés dans le traitement du cancer depuis plus de deux décennies. Ils agissent en bloquant l'action des protéines kinases, des enzymes qui contrôlent la fonction des protéines et peuvent conduire à une croissance cellulaire non régulée si elles subissent une mutation.
Bien que ces traitements puissent donner de bons résultats, il existe un risque que le cancer y devienne résistant. En effet, les inhibiteurs obstruent les protéines liées au cancer plutôt que de les détruire, et les cellules tumorales peuvent parfois les réactiver.
De plus, lorsque certaines protéines kinases sont bloquées par des inhibiteurs, la cellule compense en utilisant d'autres kinases pour effectuer les mêmes actions.
Se débarrasser entièrement des protéines par dégradation des protéines élimine ces risques.
Cette étude sert de point de départ à d'autres chercheurs qui cherchent à concevoir des colles moléculaires, à identifier des cibles protéiques prometteuses pour la dégradation et à développer de nouvelles molécules pouvant fonctionner comme thérapies dégradantes.
Thomas a déclaré :« Nous émettons l'hypothèse que d'autres inhibiteurs de petites molécules pourraient être convertis en dégradants grâce à l'ajout de certains groupes. Notre équipe étudie actuellement si certains groupes peuvent être joints à d'autres types d'inhibiteurs de kinases pour les transformer en dégradeurs monovalents. en cours pour déterminer si ces composés peuvent dégrader d'autres protéines."
En théorie, une fois que les chercheurs auront acquis une compréhension complète du dégradateur SAR, il sera possible d’éliminer une gamme de protéines favorisant le cancer dans différents types de cancer. Cette approche pourrait donc ouvrir la porte à de nouveaux traitements efficaces contre le cancer.
L'auteur correspondant, le Dr Benjamin Bellenie, scientifique principal à la Division thérapeutique du cancer de l'ICR, a déclaré :« Cette étude a considérablement amélioré notre compréhension de la conception des dégradeurs monovalents. Nous nous sommes concentrés spécifiquement sur les dégradeurs de la cycline K et devons travailler sur si nous pouvons reproduire cette approche pour de nouvelles cibles. Cependant, nous pensons que nos recherches pourraient permettre de futures découvertes de médicaments. "
Plus d'informations : Katie L. Thomas et al, Dégradation par conception :nouveaux dégradeurs de cycline K à partir d'anciens inhibiteurs de CDK, ACS Chemical Biology (2024). DOI :10.1021/acschembio.3c00616
Informations sur le journal : ACS Biologie Chimique
Fourni par l'Institut de recherche sur le cancer