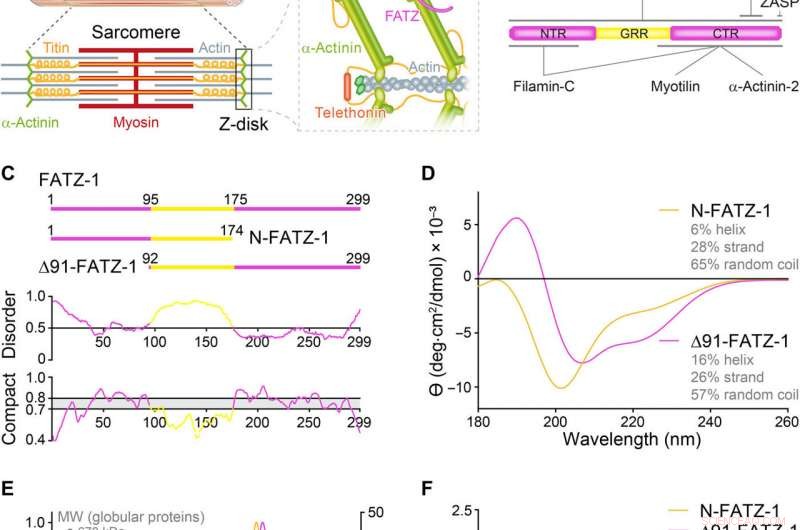
Les protéines de la famille FATZ présentent un trouble intrinsèque. (A) Schémas du sarcomère du muscle strié et vue rapprochée des interactions F-actine/α-actinine/FATZ dans le disque Z. (B) Schémas de l'interactome de FATZ-1 et des sites de liaison rapportés à ce jour. (C) Schémas des principales constructions FATZ-1, ainsi que leurs limites d'acides aminés et la composition de leur domaine. Les régions désordonnées prédites (au-dessus de 0,5) et la compacité (au-dessus de 0,8) sont présentées ci-dessous. (D) Spectres de dichroïsme circulaire (CD) de N-FATZ-1 et Δ91-FATZ-1, ainsi que le contenu calculé de la structure secondaire. (E) Analyse par chromatographie d'exclusion stérique (SEC) - diffusion de la lumière multiangle (MALS) de N-FATZ-1 et Δ91-FATZ-1, donnant des poids moléculaires (PM) de 21 et 24 kDa, respectivement. Les volumes d'élution étaient plus faibles que prévu par rapport aux standards globulaires [thyroglobuline (670 kDa), -globuline (158 kDa), ovalbumine (44 kDa), et myoglobine (17 kDa)], correspondant à des PM de 50 et 46 kDa pour N-FATZ-1 et Δ91-FATZ-1, respectivement. UV, ultra-violet. (F) Tracés de Kratky sans dimension de N-FATZ-1 et Δ91-FATZ-1, ainsi que de la sérumalbumine bovine globulaire (BSA) (code SASBDB SASDFQ8). Données expérimentales SEC-diffusion des rayons X aux petits angles (SAXS) de N-FATZ-1 (G) et Δ91-FATZ-1 (I) et ajustement correspondant aux données d'ensembles sélectionnés obtenus à partir de la méthode d'optimisation d'ensemble (EOM). Les distributions Rg des ensembles sélectionnés par rapport à la distribution d'un pool aléatoire sont indiquées dans les encarts. Représentants du modèle des ensembles EOM sélectionnés pour N-FATZ-1 (H) et Δ91-FATZ-1 (J), ainsi que leur Rg (en nanomètres) et leurs fractions volumiques (en pourcentage). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abg7653
L'alpha-actinine peut réticuler les filaments d'actine et les ancrer au disque Z dans les sarcomères. Les sarcomères sont une unité structurelle de la myofibrille dans le muscle strié. Le FATZ (filamine, La protéine de liaison à l'-actinine et à la téléthonine de la protéine du disque Z) peut interagir avec l'α-actinine et d'autres protéines centrales du disque Z qui contribuent à l'assemblage et au maintien des myofibrilles. Dans un nouveau rapport maintenant sur Avancées scientifiques , Antonio Sponga et une équipe de recherche internationale en Autriche, Allemagne, Russie, La Pologne et le Royaume-Uni ont détaillé la première structure et validation cellulaire du complexe α-actinine-2 avec un partenaire de disque Z, FATZ-1, pour former un ensemble conforme. Le FATZ-1 a formé un complexe flou serré avec l'α-actinine-2 avec un mécanisme d'interaction proposé via des éléments de reconnaissance moléculaire et des sites de liaison secondaires. Le modèle intégratif obtenu a révélé une architecture polaire du complexe en combinaison avec la fonction d'échafaudage multivalent FATZ-1 pour organiser les partenaires d'interaction et se stabiliser.
Sarcomère
Les muscles qui se contractent peuvent réguler les mouvements volontaires des animaux et les battements cardiaques involontaires, et les sarcomères sont les unités contractiles de base des cellules musculaires striées. Ils sont composés de réseaux de filaments fins (actine) et épais (myosine) qui glissent les uns sur les autres pendant la contraction. Le disque Z peut former la frontière entre les sarcomères adjacents, où sont ancrés des filaments d'actine antiparallèles. Une structure d'ancrage suffisamment stable doit être générée par l'interaction entre la myosine et l'actine. Le disque Z peut remplir ce rôle en agissant comme un hub mécanique et une plate-forme de signalisation pour permettre la transmission de la tension pendant la contraction et la durée et la transmission des informations du stress biomécanique. Par conséquent, toute mutation qui perturbe l'architecture et la fonction du disque Z pourrait risquer de provoquer un dysfonctionnement squelettique et cardiaque.
Le complexe protéique
L'alpha-actinine est une protéine de réticulation de l'actine F dans les disques Z musculaires, qui forme un composant majeur du disque Z qui réticule les filaments d'actine antiparallèles des sarcomères adjacents pour servir de plate-forme de liaison pour plusieurs protéines du disque Z, y compris FATZ-1. Les protéines FATZ peuvent se lier à l'-actinine via leur région c-terminale et aux domaines des membres de la famille Enigma via un motif de reconnaissance c-terminal spécifique. Dans ce travail, Antonio Sponga et al. a démontré comment les protéines FATZ contenaient des régions intrinsèquement désordonnées (IDR) mieux décrites comme un ensemble conformationnel, qui sont moins stables et n'ont pas de structure tertiaire stable. En plus des méthodes de caractérisation biophysique, l'équipe a utilisé la cristallographie aux rayons X et la diffusion des rayons X aux petits angles pour décrire un complexe « flou » α-actinine-2/FATZ-1. La protéine FATZ-1 peut jouer un rôle organisationnel dans le disque Z en raison de ses propriétés d'échafaudage multivalent et former un complexe serré d'architecture polaire avec la α-actinine-2.
FATZ-1 forme un complexe 2:1 étroit avec le dimère -actinine-2 via de multiples sites de liaison. (A) Schémas des constructions α-actinine-2, ainsi que leurs limites d'acides aminés et la composition de leur domaine. Analyse SEC-MALS pour l'interaction de FATZ-1, FATZ-2, et FATZ-3 avec la -actinine-2 (B), N-FATZ-1 avec bâtonnet-α-actinine-2 (C), Δ91-FATZ-1 avec hd-α-actinine-2 (D), et cinq mutants E Δ91-FATZ-1 avec -actinine-2 (E). Analyse ITC pour l'interaction de la Δ91-FATZ-1 avec la -actinine-2 (F), N-FATZ-1 avec bâtonnet-α-actinine-2 (G), Δ91-FATZ-1 avec hd-α-actinine-2 (H), et cinq mutants E 91-FATZ-1 avec -actinine-2 (I). s.d., non déterminé. (J) Rapport d'intensité du signal 1H-15N HSQC de 15N Δ91-FATZ-1 lié/libre, cartographier le site de liaison primaire de FATZ-1 pour la -actinine-2. La partie non affectée dans FATZ-1 est encadrée, et les résidus sont tracés à une position aléatoire. (K) Séquence de FATZ-1 montrant plusieurs sites d'interaction pour la -actinine-2 tel que déterminé à partir de la matrice de peptides (résidus au carré), XL-MS (étoile), LP-MS (résidus délimités par des flèches), et RMN (flèches). Les résidus correspondant au peptide signal le plus fort dans la matrice de peptides sont indiqués en gras. Les limites pour Δ91-FATZ-1 et mini-FATZ-1 sont délimitées par des flèches. Les mutations au sein de cinq E Δ91-FATZ-1 et RRE Δ91-FATZ-1 sont indiquées en orange et cyan foncé, respectivement. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abg7653 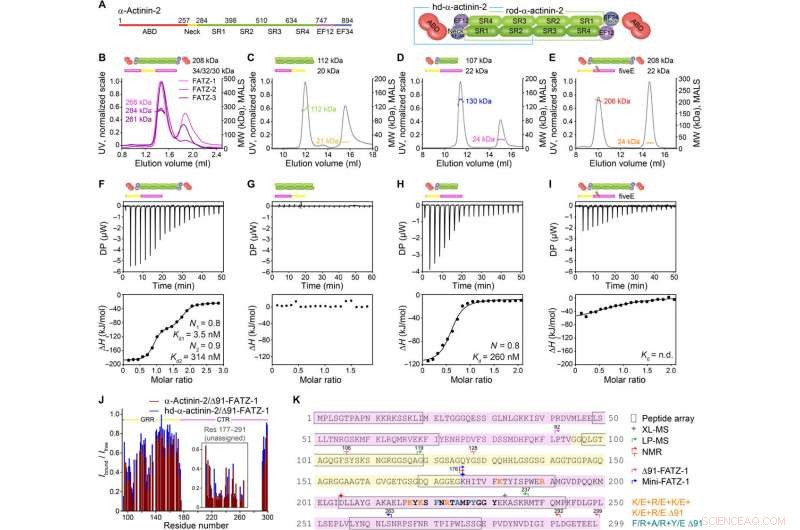
La famille de protéines FATZ se trouve chez tous les vertébrés où FATZ-1 humain, FATZ-2, et FATZ-3 partagent 34 à 40 pour cent d'identité de séquence. Les scientifiques ont reconnu des fragments résistants à la protéolyse, après avoir mené des expériences de protéolyse. Lorsqu'ils ont combiné la chromatographie d'exclusion stérique (SEC) avec la diffusion de la lumière multiangle, ils ont noté les monomères prédominants dans des conditions expérimentales. Ils ont ensuite caractérisé les monomères à l'aide de la SEC combinée à la diffusion des rayons X aux petits angles et ont également mis en évidence la nature intrinsèquement désordonnée/état d'ensemble des monomères à l'aide de spectres de cohérence quantique unique (HSQC), pour les deux constructions. Pour comprendre la stoechiométrie de liaison des protéines FATZ-1-to-3 à l'-actinine-2, Sponga et al. utilisé la chromatographie d'exclusion stérique-diffusion de la lumière multiangle (SEC-MALS). Pour caractériser la stoechiométrie de liaison des protéines FATZ-1-to-3 à l'-actinine-2, Sponga et al. utilisé SEC-MALS. Le résultat a montré comment chacune des trois protéines FATZ formait un complexe serré avec l'-actinine-2, avec une stoechiométrie de liaison de deux molécules FATZ par dimère -actinine-2. C'est une molécule de FATZ par sous-unité α-actinine-2. L'équipe a ensuite utilisé la calorimétrie de titrage isotherme (ITC) pour quantifier l'affinité de l'interaction.
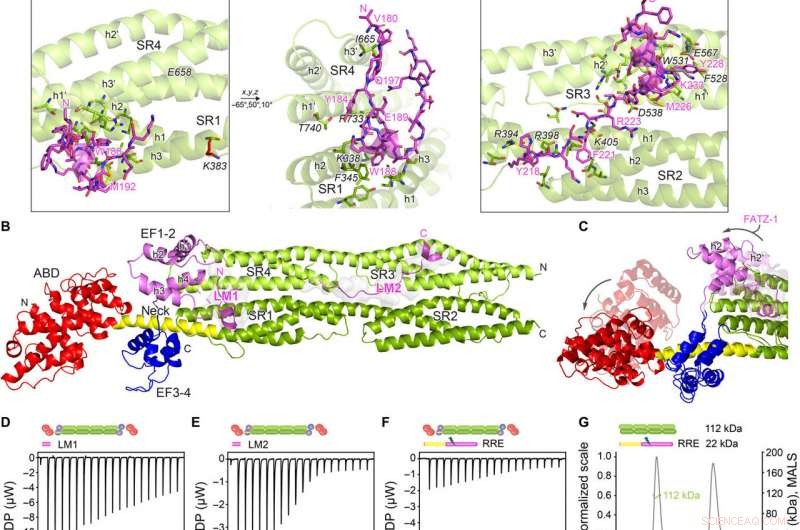
Les structures cristallines de l'α-actinine-2/FATZ-1 révèlent deux motifs de liaison linéaire dans FATZ-1. (A) Structure cristalline de la tige-α-actinine-2/mini-FATZ-1 (en vert/magenta), ainsi que la séquence consensus FATZ-1 déterminée (35 à 80 % et 60 à 84 % d'identité de séquence par paires pour LM1 et LM2, respectivement). Les résidus réticulés sont indiqués en bleu, rouge, et des étoiles/boules/bâtons gris sur la séquence/structure. Les Se-Mets identifiés sont affichés en jaune. Le dimère tige-α-actinine-2 est assemblé à travers un double axe cristallographique entre des partenaires de symétrie (cercle noir). Résidus en interaction (bâtonnet-α-actinine-2 en italique), avec les hélices de SR1/SR2 (h1, h2, et h3) et SR3/SR4 (h1′, h2′, et h3′), sont affichés dans des vues rapprochées. (B) Structure cristalline de hd-α-actinine-2/Δ91-FATZ-1 (LM1 et LM2 comme dessin animé magenta et surface grise transparente ; hd-α-actinine-2 codé par couleur comme sur la figure 2A). (C) Comparaison de non lié [code de banque de données de protéines (PDB) 4D1E] et lié (ce travail) hd-α-actinine-2. L'ABD et l'EF1-2 de la hd-α-actinine-2 non liée sont représentés en transparence. Analyse ITC pour l'interaction du peptide LM1 avec l'-actinine-2 (D), Peptide LM2 avec -actinine-2 (E), et RRE 91-FATZ-1 mutant avec α-actinine-2 (F). Analyse SEC-MALS pour l'interaction du mutant RRE Δ91-FATZ-1 avec la tige-α-actinine-2 (G) et Δ91-FATZ-1 avec la tige-α-actinine-2 (H) d'E. histolytica. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abg7653
Sites de liaison multiples pour le complexe protéique
L'équipe a noté comment FATZ-1 interagissait avec l'-actinine-2 via plusieurs sites de liaison. Pour affiner les sites de liaison FATZ-1, Sponga et al. ont utilisé une protéolyse limitée et une réticulation chimique couplée à la spectrométrie de masse sur le complexe protéique. Pour aider ensuite à la cristallisation de ce complexe protéique, l'équipe a ensuite également combiné les informations de la matrice de peptides et généré une construction plus courte connue sous le nom de mini-FATZ-1 pour d'autres études sur leur biologie structurelle. Les scientifiques ont ensuite validé les modèles flous développés dans le cadre de ces travaux à l'aide de la viscosité intrinsèque calculée et dérivée expérimentalement, un paramètre hydrodynamique de la conformation des protéines. Pour ensuite comprendre la contribution de la -actinine-2 pour localiser les protéines FATZ sur le disque Z du sarcomère, Sponga et al. transfecté des protéines FATZ-1 ou FATZ-2 marquées par GFP dans des myoblastes de souris immortalisés ou des cardiomyocytes de rats nouveau-nés. Les protéines FATZ-1 et -2 ciblaient correctement le disque Z et étaient colocalisées avec la -actinine-2.
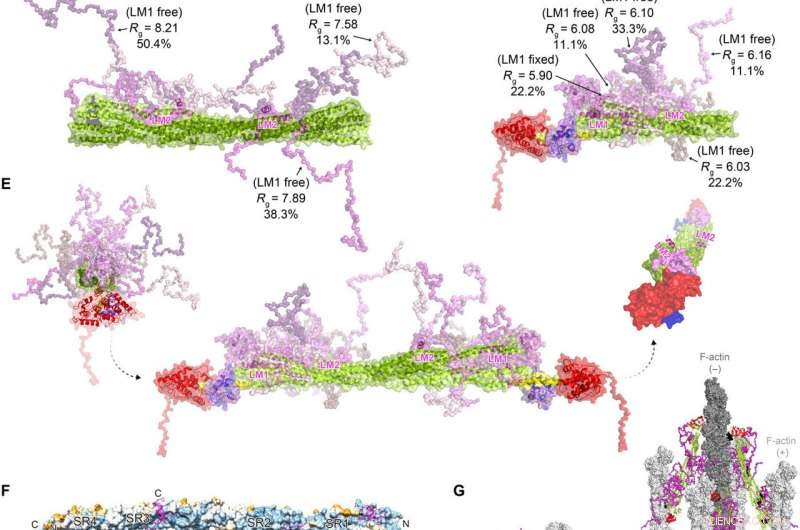
FATZ-1 forme un complexe flou avec la -actinine-2 résultant en une architecture polaire du complexe. Données expérimentales SAXS de tige-α-actinine-2/Δ91-FATZ-1 (A) et hd-α-actinine-2/Δ91-FATZ-1 (B), avec le modèle correspondant s'adapte aux données des ensembles sélectionnés. GAJOE, Algorithme génétique jugeant l'optimisation des ensembles. Régions flexibles de Δ91-FATZ-1, non visible dans nos structures cristallines déterminées, ont été générés avec EOM gardant LM1 fixe ou libre (10, 000 modèles pour chacun). Représentants sélectionnés du modèle d'ensemble pour rod-α-actinin-2/Δ91-FATZ-1 (C) et hd-α-actinin-2/Δ91-FATZ-1 (D) , ainsi que leur Rg et leurs fractions volumiques au sein de l'ensemble. (E) Modèle intégratif de la α-actinine-2/Δ91-FATZ-1 floue construit à l'aide de la cristallographie aux rayons X et des modèles SAXS de hd-α-actinine-2/Δ91-FATZ-1. Rotation des hélices LM2 des molécules FATZ-1 liées les unes par rapport aux autres, ainsi qu'une torsion de la tige le long de l'axe longitudinal α-actinine-2, est illustré dans l'encart à droite (les pièces flexibles de FATZ-1 sont omises pour plus de clarté). (F) Surface de la structure tige-α-actinine-2/FATZ-1 montrant la conservation de la séquence des résidus d'interaction α-actinine pour FATZ-1 (alignement effectué à l'aide de 1505 α-actinines de vertébrés). (G) Modèle de F-actine/α-actinine-2/FATZ-1 (F-actine en gris clair et gris foncé) basé sur une structure de cryo-tomographie électronique du disque Z et du modèle intégratif. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abg7653
Perspectives
De cette façon, Antonio Sponga et ses collègues ont décrit comment l'assemblage du sarcomère a commencé à partir des corps Z de la -actinine-2, inclure des protéines telles que FATZ, myotiline, et actine, pour n'en nommer que quelques-uns. Le résultat indique que les protéines de la famille FATZ sont disponibles dans les corps Z et les disques Z matures avec un rôle dans les voies de signalisation des protéines pour lier la calcineurine. L'équipe a souligné le rôle de FATZ-1, le membre de la famille le plus étudié et son interaction avec la principale protéine du disque Z α-actinine-2. La structure et le mécanisme de liaison du complexe flou α-actinine-2/FATZ-1 ont soutenu la fonction de FATZ-1 en tant que protéine d'échafaudage classique dans l'assemblage du disque Z. D'autres études révéleront si les mêmes principes s'appliquent dans des conditions physiologiques dans des cellules vivantes.
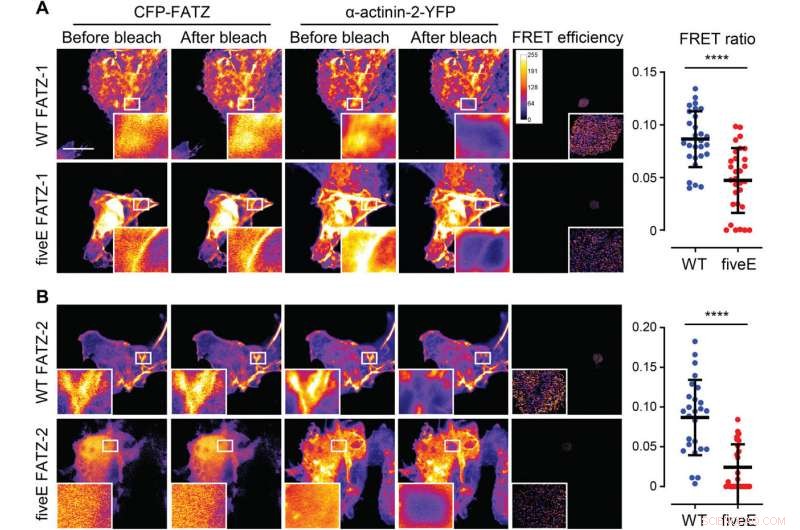
L'α-actinine-2 stabilise les protéines FATZ au niveau du disque Z. (A) Cellules COS-1 co-exprimant la CFP améliorée (ECFP)-marquées FATZ-1 (WT FATZ-1) ou le mutant fiveE correspondant, en association avec l'actinine-2-EYFP, tel que déterminé dans les cellules fixées par photoblanchiment de l'accepteur. Des images représentatives sont présentées avant et après le blanchiment pour les deux protéines. Les régions d'intérêt blanchies sont affichées (encarts), ainsi que les efficacités de FRET utilisées pour calculer les ratios de FRET présentés dans le graphique adjacent [n =28 (WT) et 30 (fiveE), ****P <0,0005, test t de Student). (B) Mêmes cellules qu'en (A) mais co-exprimant des variantes de FATZ-2 marquées par ECFP en combinaison avec EYFP-α-actinine-2 [n =26 (WT) et 25 (fiveE), ****P <0,0005, test t de Student). Barres d'échelle, 10 m dans toutes les images. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abg7653
© 2021 Réseau Science X