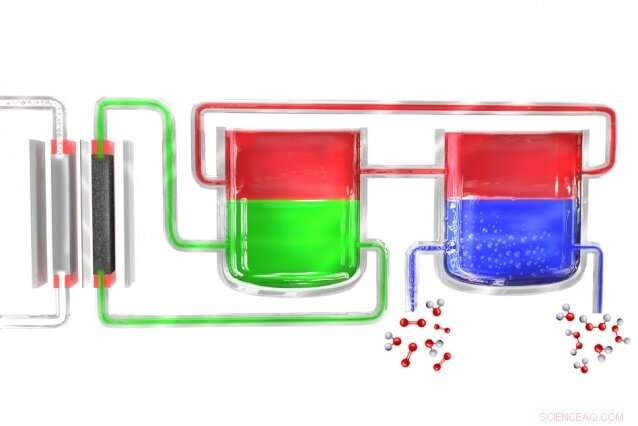
Dans une nouvelle méthode pour produire du peroxyde d'hydrogène de manière portable, un électrolyseur (à gauche) divise l'eau en hydrogène et oxygène. Les atomes d'hydrogène se forment initialement dans un matériau électrolytique (vert), qui les transfère vers un matériau médiateur (rouge), qui les transporte ensuite vers une unité séparée où le médiateur entre en contact avec de l'eau riche en oxygène (bleu), où l'hydrogène se combine avec lui pour former du peroxyde d'hydrogène. Le médiateur revient alors pour recommencer le cycle. Crédit : Institut de technologie du Massachusetts
Peroxyde d'hydrogène, un désinfectant tout usage utile, se trouve dans la plupart des armoires à pharmacie dans le monde développé. Mais dans les villages reculés des pays en développement, où il pourrait jouer un rôle important dans la santé et l'assainissement, il peut être difficile à trouver.
Maintenant, un processus développé au MIT pourrait conduire à un peu coûteux, appareil portable qui pourrait produire du peroxyde d'hydrogène en continu à partir d'air, l'eau, et l'électricité, fournir un moyen de stériliser les plaies, surfaces de préparation des aliments, et même l'approvisionnement en eau.
La nouvelle méthode est décrite cette semaine dans la revue Joule dans un article des étudiants du MIT Alexander Murray, Sahag Voskian, et Marcel Schreier et les professeurs du MIT T. Alan Hatton et Yogesh Surendranath.
Même à de faibles concentrations, le peroxyde d'hydrogène est un agent antibactérien efficace, et après avoir exercé sa fonction de stérilisation, il se décompose en eau plate, contrairement à d'autres agents tels que le chlore qui peuvent laisser des sous-produits indésirables de sa production et de son utilisation.
Le peroxyde d'hydrogène n'est que de l'eau avec un atome d'oxygène supplémentaire, c'est H2O2, au lieu de H2O. Cet oxygène supplémentaire est relativement faiblement lié, ce qui en fait un produit chimique hautement réactif désireux d'oxyder toutes les autres molécules qui l'entourent. Il est si réactif qu'à des concentrations élevées, il peut être utilisé comme carburant pour fusée, et même des concentrations de 35 pour cent nécessitent des procédures de manutention et d'expédition très spéciales. Le type utilisé comme désinfectant ménager ne contient généralement que 3 % de peroxyde d'hydrogène et 97 % d'eau.
Parce que les concentrations élevées sont difficiles à transporter, et de faibles concentrations, étant principalement de l'eau, ne sont pas économiques à expédier, le matériel est souvent difficile à obtenir dans des endroits où il pourrait être particulièrement utile, comme les communautés éloignées avec de l'eau non traitée. (Les bactéries présentes dans les réserves d'eau peuvent être efficacement contrôlées en ajoutant du peroxyde d'hydrogène.) En conséquence, de nombreux groupes de recherche à travers le monde ont poursuivi des approches pour développer une certaine forme d'équipement de production de peroxyde d'hydrogène portable.
La plupart du peroxyde d'hydrogène produit dans le monde industrialisé est fabriqué dans de grandes usines chimiques, où le méthane, ou gaz naturel, est utilisé pour fournir une source d'hydrogène, qui est ensuite mis à réagir avec de l'oxygène dans un processus catalytique à haute température. Ce processus est énergivore et difficilement évolutif, nécessitant de gros équipements et un approvisionnement régulier en méthane, il ne se prête donc pas à des unités plus petites ou à des emplacements éloignés.
"Il y a une communauté croissante qui s'intéresse au peroxyde d'hydrogène portable, " Surendranath dit, « en raison de l'appréciation que cela permettrait vraiment de répondre à beaucoup de besoins, tant sur le plan industriel qu'en termes de santé humaine et d'assainissement."
D'autres processus développés jusqu'à présent pour des systèmes potentiellement portables ont des limitations clés. Par exemple, la plupart des catalyseurs qui favorisent la formation de peroxyde d'hydrogène à partir d'hydrogène et d'oxygène produisent également beaucoup d'eau, conduisant à de faibles concentrations du produit souhaité. Aussi, processus qui impliquent l'électrolyse, comme le fait ce nouveau processus, ont souvent du mal à séparer le peroxyde d'hydrogène produit du matériau électrolytique utilisé dans le processus, conduisant à nouveau à une faible efficacité.
Surendranath et le reste de l'équipe ont résolu le problème en divisant le processus en deux étapes distinctes. D'abord, l'électricité (de préférence à partir de cellules solaires ou d'éoliennes) est utilisée pour décomposer l'eau en hydrogène et oxygène, and the hydrogen then reacts with a "carrier" molecule. This molecule—a compound called anthroquinone, in these initial experiments—is then introduced into a separate reaction chamber where it meets with oxygen taken from the outside air, and a pair of hydrogen atoms binds to an oxygen molecule (O2) to form the hydrogen peroxide. Dans le processus, the carrier molecule is restored to its original state and returns to carry out the cycle all over again, so none of this material is consumed.
The process could address numerous challenges, Surendranath says, by making clean water, first-aid care for wounds, and sterile food preparation surfaces more available in places where they are presently scarce or unavailable.
"Even at fairly low concentrations, you can use it to disinfect water of microbial contaminants and other pathogens, " Surendranath says. And, he adds, "at higher concentrations, it can be used even to do what's called advanced oxidation, " where in combination with UV light it can be used to decontaminate water of even strong industrial wastes, for example from mining operations or hydraulic fracking.
Donc, par exemple, a portable hydrogen peroxide plant might be set up adjacent to a fracking or mining site and used to clean up its effluent, then moved to another location once operations cease at the original site.
In this initial proof-of-concept unit, the concentration of hydrogen peroxide produced is still low, but further engineering of the system should lead to being able to produce more concentrated output, Surendranath says. "One of the ways to do that is to just increase the concentration of the mediator, and fortunately, our mediator has already been used in flow batteries at really high concentrations, so we think there's a route toward being able to increase those concentrations, " il dit.
"It's kind of an amazing process, " il dit, "because you take abundant things, l'eau, air and electricity, that you can source locally, and you use it to make this important chemical that you can use to actually clean up the environment and for sanitation and water quality."
"The ability to create a hydrogen peroxide solution in water without electrolytes, salt, base, etc., all of which are intrinsic to other electrochemical processes, is noteworthy, " says Shannon Stahl, a professor of chemistry at the University of Wisconsin, qui n'a pas participé à ce travail. Stahl adds that "Access to salt-free aqueous solutions of H2O2 has broad implications for practical applications."
Stahl says that "This work represents an innovative application of 'mediated electrolysis.' Mediated electrochemistry provides a means to merge conventional chemical processes with electrochemistry, and this is a particularly compelling demonstration of this concept. … There are many potential applications of this concept."
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.