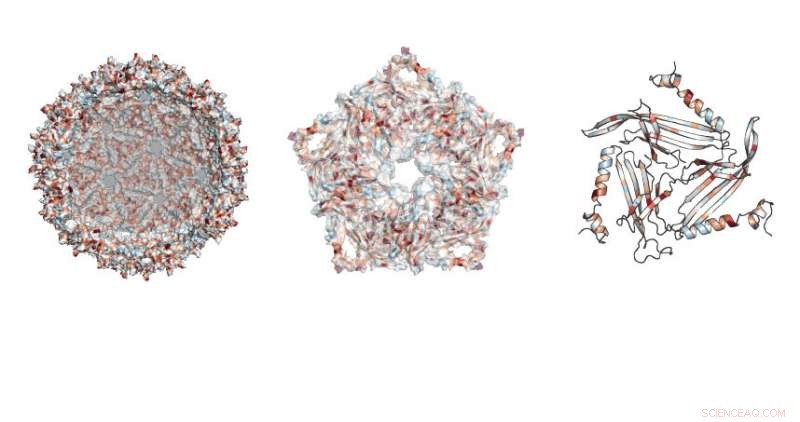
Les chercheurs ont étudié où les mutations étaient autorisées dans la structure semblable à un ballon de football créée par l'échafaudage MS2. Crédit :Université Northwestern
Les chercheurs de Northwestern Engineering ont développé une nouvelle façon de manipuler une enveloppe virale qui s'auto-assemble à partir de protéines et est prometteuse en tant que vecteur de détection de maladies. l'administration de médicaments, et vaccins.
Les virus ont des coquilles conçues pour survivre dans des conditions difficiles, protéger leur cargaison jusqu'à ce qu'ils trouvent une cellule à infecter. La coquille peut être utilisée pour de bon, cependant, parce que cette stabilité le rend approprié pour protéger une cargaison plus utile, comme les médicaments, qui peuvent être délivrés à des cellules spécifiquement ciblées.
La recherche s'est concentrée sur une protéine utilisée par un virus bactérien appelé le bactériophage MS2. Cette protéine peut s'auto-assembler, créer un échafaudage inoffensif à partir de la coque virale, dit Danielle Tullman-Ercek, professeur agrégé de génie chimique et biologique à la McCormick School of Engineering.
« En biologie, tout a sa place. La biologie, c'est bien comme ça, sauf qu'on ne connaît pas les règles, " Tullman-Ercek a déclaré. "Notre découverte était la méthode pour déterminer ces règles de conception."
L'étude, réalisé en collaboration avec le professeur de chimie Matthew Francis et ses collègues de l'Université de Californie à Berkeley, a pris plus de deux ans. Les résultats ont été publiés le 11 avril dans la revue Communication Nature .
Les travaux ont permis aux chercheurs d'examiner quelles mutations protéiques spécifiques ont brisé l'échafaudage du virus ou modifié les propriétés de la structure. Pour faire ça, l'équipe a développé une nouvelle technique appelée SyMAPS (Systematic Mutation and Assembled Particle Selection), qui a séparé les protéines d'échafaudage mutées qui sont restées intactes de celles qui se sont séparées pendant la mutation.
Au total, l'équipe en a testé près de 2, 600 versions de la protéine, qui constitue la coquille fermée, échafaudage en forme de ballon de football.
"La protéine d'échafaudage MS2 a 129 positions où nous pouvons faire des substitutions, remplacer l'acide aminé existant à cette position par tous les autres acides aminés, " a déclaré Emily Hartman, un doctorant de quatrième année en chimie à l'UC Berkeley et auteur principal de l'article. "En échangeant les 20 acides aminés naturels, un à la fois, à chaque position dans la protéine, nous finissons par tester 20 variables à 129 positions."
L'équipe pense que comprendre comment les mutations modifient l'échafaudage fournit des informations importantes sur la façon dont ces protéines virales réutilisées pourraient être utilisées en médecine.
« L'échafaudage que vous souhaitez pour l'administration de médicaments peut être différent de ce que vous voudriez pour un vaccin, " Tullman-Ercek a déclaré. "Nous pourrions vouloir changer les propriétés de charge sur la surface pour obtenir un meilleur ciblage ou ajouter quelque chose à l'intérieur de la structure, comme le charger avec un capteur ou un enregistreur de diagnostic."
Par exemple, une structure qui s'effondre dans un environnement spécifique pourrait aider à l'administration ciblée de médicaments, comme la chimiothérapie.
"L'une des choses que nous avons faites dans l'étude était de rechercher des mutants sensibles à l'acide, " Hartman a dit. " La circulation sanguine n'est pas acide, mais une fois dans une cellule cancéreuse, c'est beaucoup plus acide. Si l'échafaudage se désagrège dans des environnements acides, cela libérerait le médicament à l'intérieur d'une cellule cancéreuse plus facilement. »
Une structure moins tolérante aux conditions acides a été trouvée, et l'équipe continuera à travailler dans ce domaine.
En outre, l'étude offre un aperçu de ce qui pourrait survenir naturellement dans un virus en mutation, comme la grippe. "Cela pourrait nous donner une idée des endroits dans le virus qui pourraient avoir un taux de mutation plus élevé. Cette information pourrait être utilisée par les scientifiques pour développer de nouveaux vaccins, " a déclaré Tullman-Ercek.
L'équipe et leurs collègues des deux universités utiliseront les travaux comme base d'applications spécifiques pour l'échafaudage viral, elle a dit.
"Cet article est vraiment une première étape dans un ensemble plus large d'histoires, " a déclaré Hartman. " Il y a beaucoup de travail en cours dans cette collaboration entre les universités. J'ai hâte de voir où ça va.
L'étude s'appuie sur les travaux antérieurs de Tullman-Ercek, qui a constaté qu'une seule mutation d'acide aminé dans le même échafaudage de bactériophage MS2 modifiait considérablement sa taille.
Tullman-Ercek est membre du corps professoral du Centre de biologie synthétique de Northwestern. Le centre de deux ans rassemble des scientifiques de l'ingénierie, Médicament, la physique, et l'informatique intéressée à manipuler la biologie pour aider la société. Une grande partie de la biologie synthétique se concentre sur le changement d'une cellule en changeant son ADN, créer de nouveaux produits spécialisés.