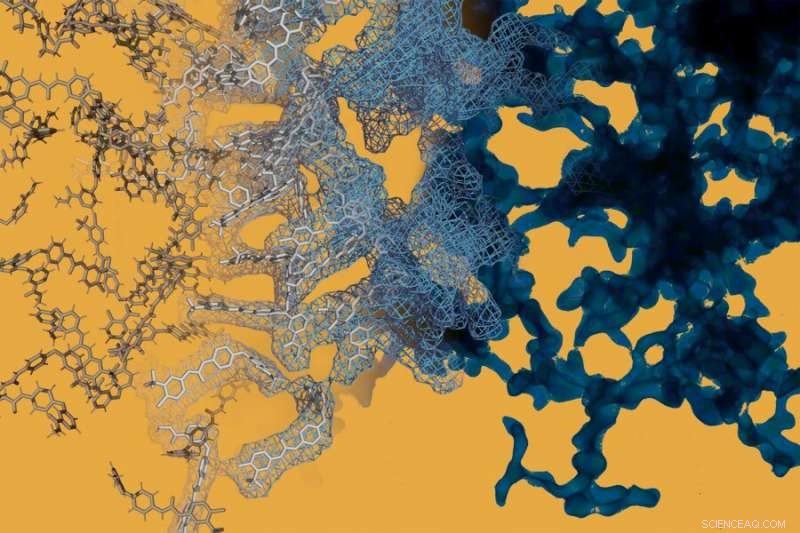
Une simulation de dynamique moléculaire (à gauche) est juxtaposée à une image en microscopie électronique (à droite) du médicament anticancéreux sorafenib. Sorafénib, comme beaucoup d'autres médicaments à petites molécules, peuvent former spontanément des structures complexes à l'échelle nanométrique qui modifient le comportement du médicament. Crédit :Daniel Reker
Les thérapies à base de petites molécules traitent une grande variété de maladies, mais leur efficacité est souvent diminuée en raison de leur pharmacocinétique – ce que le corps fait à un médicament. Après administration, le corps dicte la quantité de médicament absorbée, dans quels organes pénètre le médicament, et à quelle vitesse le corps métabolise et excrète le médicament à nouveau.
Nanoparticules, généralement constitué de lipides, polymères, ou les deux, peut améliorer la pharmacocinétique, mais ils peuvent être complexes à produire et contiennent souvent très peu de médicament.
Il a été démontré que certaines combinaisons de médicaments anticancéreux à petites molécules et de deux colorants à petites molécules s'auto-assemblent en nanoparticules avec des charges utiles de médicaments extrêmement élevées, mais il est difficile de prédire quels partenaires de petites molécules formeront des nanoparticules parmi les millions d'appariements possibles.
Les chercheurs du MIT ont développé une plate-forme de criblage qui combine l'apprentissage automatique et l'expérimentation à haut débit pour identifier rapidement les nanoparticules qui s'auto-assemblent. Dans une étude publiée dans Nature Nanotechnologie , les chercheurs ont examiné 2,1 millions d'associations de médicaments à petites molécules et d'ingrédients médicamenteux « inactifs », identifier 100 nouvelles nanoparticules avec des applications potentielles qui incluent le traitement du cancer, asthme, paludisme, et les infections virales et fongiques.
"Nous avons précédemment décrit certains des effets négatifs et positifs que les ingrédients inactifs peuvent avoir sur les médicaments, et ici, grâce à une collaboration concertée entre nos laboratoires et nos installations centrales, décrire une approche axée sur les effets positifs potentiels qu'elles peuvent avoir sur la nanoformulation, " dit Giovanni Traverso, le Karl Van Tassel (1925) professeur de développement de carrière en génie mécanique, et auteur principal correspondant de l'étude.
Leurs résultats indiquent une stratégie qui résout à la fois la complexité de la production de nanoparticules et la difficulté de charger de grandes quantités de médicaments sur celles-ci.
"Tant de médicaments n'atteignent pas leur plein potentiel en raison d'un ciblage insuffisant, faible biodisponibilité, ou métabolisme rapide des médicaments, " dit Daniel Reker, auteur principal de l'étude et ancien post-doctorant dans le laboratoire de Robert Langer. "En travaillant à l'interface de la science des données, apprentissage automatique, et l'administration de médicaments, notre espoir est d'étendre rapidement notre ensemble d'outils pour nous assurer qu'un médicament arrive à l'endroit où il doit être et peut réellement traiter et aider un être humain. »
Langer, le professeur David H. Koch Institute au MIT et membre du Koch Institute for Integrative Cancer Research, est également un auteur principal de l'article.
Une thérapie contre le cancer à la hauteur
Afin de développer un algorithme d'apprentissage automatique capable d'identifier des nanoparticules auto-assemblantes, les chercheurs devaient d'abord créer un ensemble de données sur lequel l'algorithme pourrait s'entraîner. Ils ont sélectionné 16 médicaments à petites molécules auto-agrégés avec une variété de structures chimiques et d'applications thérapeutiques et un ensemble diversifié de 90 composés largement disponibles, y compris les ingrédients qui sont déjà ajoutés aux médicaments pour leur donner un meilleur goût, dure plus longtemps, ou les rendre plus stables. Parce que les médicaments et les ingrédients inactifs sont déjà approuvés par la FDA, les nanoparticules résultantes sont susceptibles d'être plus sûres et de franchir plus rapidement le processus d'approbation de la FDA.
L'équipe a ensuite testé chaque combinaison de médicament à petite molécule et d'ingrédient inactif, permis par le Swanson Biotechnology Center, une suite d'installations de base fournissant des services techniques avancés au sein de l'Institut Koch. Après avoir mélangé les appariements et chargé 384 échantillons à la fois sur des plaques de nanopuits à l'aide de la robotique dans le cœur High Throughput Sciences, les chercheurs ont marché dans les assiettes, souvent avec des échantillons qui se dégradent rapidement, à côté du noyau Peterson (1957) Nanotechnology Materials Core Facility pour mesurer la taille des particules avec une diffusion dynamique de la lumière à haut débit.
Maintenant formé le 1, 440 points de données (avec 94 nanoparticules déjà identifiées), la plate-forme d'apprentissage automatique pourrait être activée sur une bibliothèque de composés beaucoup plus grande. Criblage de 788 médicaments à petites molécules contre plus de 2, 600 ingrédients médicamenteux inactifs, la plateforme a identifié 38, 464 nanoparticules potentielles d'auto-assemblage à partir de 2,1 millions de combinaisons possibles.
Les chercheurs ont sélectionné six nanoparticules pour une validation plus poussée, dont un composé de sorafénib, un traitement couramment utilisé pour le foie avancé et d'autres cancers, et la glycyrrhizine, un composé fréquemment utilisé comme additif alimentaire et médicamenteux et plus communément appelé arôme de réglisse. Bien que le sorafénib soit la norme de soins pour le cancer du foie avancé, son efficacité est limitée.
Dans les cultures de cellules cancéreuses du foie humain, les nanoparticules de sorafénib-glycyrrhizine ont fonctionné deux fois plus que le sorafénib seul, car une plus grande quantité de médicament pouvait pénétrer dans les cellules. Travailler avec la modélisation préclinique, Installation d'imagerie et de test à l'Institut Koch, les chercheurs ont traité des modèles murins de cancer du foie pour comparer les effets des nanoparticules de sorafénib-glycyrrhizine par rapport à l'un ou l'autre composé en lui-même. Ils ont découvert que la nanoparticule réduisait considérablement les niveaux d'un marqueur associé à la progression du cancer du foie par rapport aux souris ayant reçu du sorafénib seul, et ont vécu plus longtemps que les souris ayant reçu du sorafénib ou de la glycyrrhizine seuls. La nanoparticule de sorafénib-glycyrrhizine a également montré un meilleur ciblage vers le foie par rapport à l'administration orale de sorafénib, la norme actuelle dans la clinique, ou lors de l'injection de sorafénib après son association avec le crémophor, un véhicule médicamenteux couramment utilisé qui améliore la solubilité dans l'eau mais a des effets secondaires toxiques.
Livraison de médicaments personnalisée
La nouvelle plate-forme peut avoir des applications utiles au-delà de l'optimisation de l'efficacité des médicaments actifs :elle pourrait être utilisée pour personnaliser les composés inactifs afin de répondre aux besoins de chaque patient. Dans des travaux antérieurs, Les membres de l'équipe ont découvert que les ingrédients inactifs pouvaient provoquer des réactions allergiques indésirables chez certains patients. Maintenant, avec la boîte à outils d'apprentissage automatique étendue, davantage d'options pourraient être générées pour offrir des alternatives à ces patients.
"Nous avons l'opportunité de réfléchir à l'adéquation du système de délivrance au patient, " explique Reker, maintenant professeur adjoint de génie biomédical à l'Université Duke. "Nous pouvons expliquer des choses comme l'absorption de médicaments, la génétique, même les allergies pour réduire les effets secondaires lors de l'accouchement. Quelle que soit la mutation ou la condition médicale, le bon médicament n'est le bon médicament que s'il fonctionne réellement pour le patient."
Les outils pour la sécurité, une administration efficace des médicaments existe, mais rassembler tous les ingrédients peut être un processus lent. La combinaison de l'apprentissage automatique, dépistage rapide, et la capacité de prédire les interactions entre différentes combinaisons de matériaux accélérera la conception des médicaments et des nanoparticules utilisées pour les délivrer dans tout le corps.
Dans les travaux en cours, l'équipe cherche non seulement à améliorer l'administration efficace des médicaments, mais également à créer des médicaments pour les personnes pour lesquelles les formulations standard ne sont pas une bonne option, utiliser les mégadonnées pour résoudre des problèmes dans de petites populations en examinant l'histoire génétique, allergiques, et les réactions alimentaires.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.