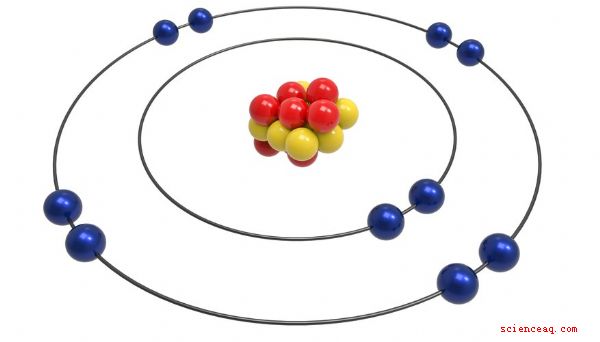
Le rayon d'un atome est la distance entre le centre de son noyau et ses électrons ultrapériphériques. La taille des atomes des différents éléments - l'hydrogène, l'aluminium et l'or, par exemple - change en fonction de la taille du noyau et de la quantité d'énergie des électrons. En regardant un tableau périodique qui répertorie le rayon atomique, vous pouvez voir comment l'emplacement d'un élément dans le tableau affecte la taille de l'atome.
TL; DR (trop long; n'a pas lu)
Le le nombre d'électrons dans un atome affecte son rayon, de même que l'énergie des électrons.
Structure atomique
Un atome est constitué d'un noyau central de protons et de neutrons entouré d'un nuage d'électrons. La taille de l'atome dépend d'un acte d'équilibrage impliquant quelques forces différentes. Le proton a une charge électrique positive, tandis que l'électron est négatif. Les deux types de particules s’attirent - plus l’attraction est forte, plus le rayon de l’atome a tendance à être petit. Cependant, un atome avec de nombreux électrons ne les rassemble pas dans le même espace. Ils occupent plusieurs «coquilles» concentriques, donc plus il y a d'électrons, plus il y a de coquilles et plus l'atome est gros. Un effet appelé «écran» complique la force exercée par un gros noyau. Les protons les plus externes bloquent les protons intérieurs, ce qui réduit l'attraction globale sur les électrons.
Numéro atomique
À mesure que le numéro atomique d'un élément augmente, la taille de son noyau et le nombre d'électrons qui l'entourent augmentent également. . Plus le numéro atomique est grand, plus le rayon de l'atome est grand. Cela est particulièrement vrai lorsque vous vous déplacez vers le bas d'une colonne donnée du tableau périodique; le rayon de chaque atome voisin successif augmente. La taille croissante est due au nombre croissant de coquilles d'électrons remplies lorsque vous descendez dans le tableau périodique.
Ligne du tableau périodique
Dans le tableau périodique, le rayon atomique des éléments a tendance à diminuer lorsque vous vous déplacez à travers une rangée de gauche à droite. Le nombre de protons augmente de gauche à droite, conduisant à une plus grande force d'attraction dans le noyau. L'attraction plus forte rapproche les électrons, ce qui réduit le rayon.
Énergie électronique
Les courants électriques et la lumière transportent tous deux de l'énergie. Si la quantité d'énergie est suffisamment grande, les électrons d'un atome peuvent l'absorber. Cela fait que les électrons sautent temporairement vers une coquille plus éloignée du noyau, augmentant le rayon de l'atome. À moins que l'électron ne vole complètement loin de l'atome, il libère l'énergie qu'il vient de recevoir et retombe dans sa coquille d'origine. Lorsque cela se produit, le rayon de l'atome se réduit à la normale.