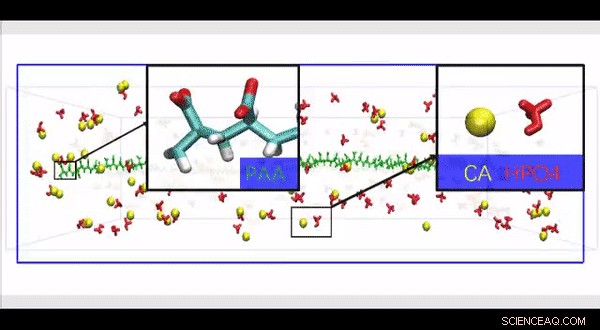
Simulation complète de la dynamique moléculaire atomistique d'une structure HPAA-collagène haute résolution construite pour étudier l'effet de la présence de grosses molécules de polyélectrolyte le long de la surface de la fibrille de collagène sur le mouvement et l'infiltration des ions dans un modèle biomimétique. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav9075.
Les organismes vivants forment des minéraux biologiques lors de la biominéralisation, où les éléments inorganiques peuvent se déposer sélectivement sur des macromolécules organiques spécifiques sous un contrôle précis. Le procédé peut être divisé en biocalcification ou biosilicification sur la base du composant inorganique, avec du collagène utilisé comme modèle universel. Lors de la minéralisation intrafibrillaire, les matrices de collagène destinées à la minéralisation chez les vertébrés contiennent des protéines matricielles liées à la surface. Comprendre les mécanismes complexes de la minéralisation intrafibrillaire pour former des tissus collagènes durs tels que l'os et la dentine est d'un intérêt significatif en biomécanique, avec des décennies d'études menées pour imiter ou modéliser le processus en laboratoire. Dans une étude récente, maintenant publié dans Avancées scientifiques , Q. Song et collaborateurs des départements interdisciplinaires de biologie, Physique appliquée, Science et génie des matériaux, Sciences biomédicales et médecine dentaire, en Chine, les États-Unis et l'Italie, ont développé un modèle biomécanique pour examiner les interactions collagène-ligand contribuant à la minéralisation intrafibrillaire.
Dans l'étude, ils ont utilisé une charge négative, acide polycarboxylique de haut poids moléculaire, réticulé au collagène reconstitué, pour créer le modèle biomimétique. Ils ont réalisé des simulations de microscopie électronique cryogénique et de dynamique moléculaire, pour montrer que des agrégats en forme de chaîne se sont formés après réticulation au collagène, le long de la surface fibrillaire pour mettre en œuvre une minéralisation fibrillaire. Ils ont observé que les charges négativement, les échafaudages minéralisés leur ont permis d'atteindre une qualité supérieure avec de meilleures propriétés biomécaniques, par rapport à la minéralisation sur des échafaudages non modifiés. Les travaux sur l'interaction collagène-ligand ont fourni aux scientifiques des informations sur l'origine des tissus minéralisés de manière hétérogène et ont également clarifié les causes potentielles de la calcification ectopique (biominéralisation inappropriée) dans les tissus corporels non minéralisés.
Les biominéraux présents dans la nature contiennent intrinsèquement du calcium pour former du phosphate de calcium (CaP) et du phosphate octacalcique à titre d'exemples. Les biominéraux contenant du CaP constituent spécifiquement les tissus conjonctifs durs vertébraux, tandis que le carbonate de calcium forme le squelette invertébral. Les fibrilles de collagène peuvent être utilisées comme modèles de minéralisation en raison des canaux nanométriques dans leurs structures fibrillaires pour former des hybrides nano-ingénierie avec une force et une résilience combinées. Cependant, le procédé ne peut pas être réalisé en immergeant simplement des matrices de collagène dans une solution sursaturée d'ions minéraux, nécessitant plutôt l'utilisation d'inhibiteurs de nucléation pour stabiliser les complexes d'association d'ions et empêcher leur cristallisation à l'extérieur des fibrilles. Par conséquent, au cours de la dernière décennie, les scientifiques ont proposé différents modèles in vitro pour comprendre les mécanismes de la minéralisation intrafibrillaire. Dans les modèles d'étude précédents, des inhibiteurs de nucléation cristalline ont été inclus dans le milieu de minéralisation et non liés aux fibrilles de collagène, s'écartant du scénario typique qui s'est produit dans les systèmes biologiques. Dans le présent modèle d'étude, Song et al. donc permis aux inhibiteurs de se lier aux fibrilles de collagène pour un biomimétisme adéquat.
Caractérisation du PAA-collagène. (A) Spectres infrarouges d'éponges PAA-collagène. Les spectres ont été normalisés le long du pic de l'amide de collagène A (~ 3300 cm-1, étirement NH couplé à une liaison hydrogène) Par rapport au spectre du collagène nu, les spectres des éponges de collagène lié à l'HPAA (HPAA-collagène) et de collagène lié à la LPAA (LPAA-collagène) montrent des augmentations de l'amide B, JE, II, et III pics. (B) Surface solide ζ potentiel du collagène HPAA, LPAA-collagène, et du collagène nu. La réticulation du PAA à la molécule de collagène a entraîné des potentiels significativement plus faibles de -17,17 ± 1,98 mV pour le collagène HPAA, −15,19 ± 1,22 mV pour le LPAA-collagène, et -3,04 ± 0,37 mV pour le collagène nu. (C et D) Comparaison des groupes carboxyle (C) et amine (D) entre le collagène PAA et le collagène nu. Après modification anionique, les quantités de groupement carboxyle (en mM/g de collagène) dans le collagène HPAA (1,907 ± 0,084) et LPAA-collagène (1,807 ± 0,035) étaient significativement supérieures à celle du collagène nu (0,460 ± 0,017). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav9075. 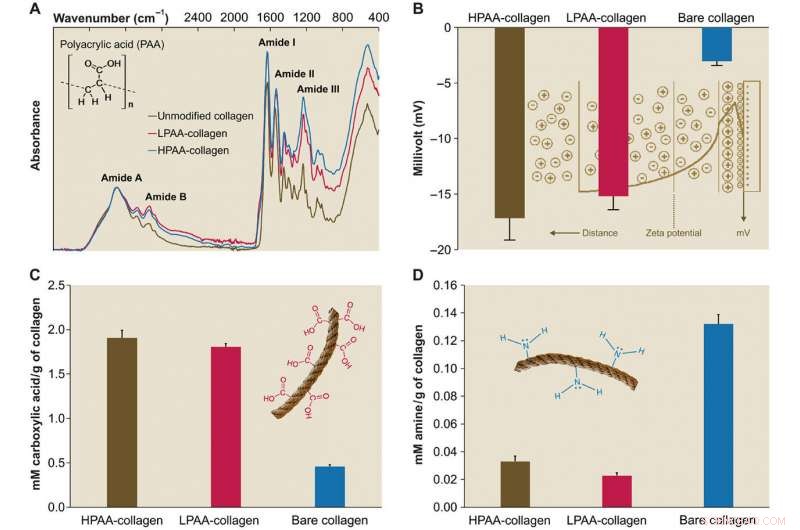
Étant donné que les protéines physiologiques non collagènes sont difficiles à extraire et fonctionnellement complexes pour une utilisation dans les études de minéralisation biomimétiques, Song et al. ont utilisé des polyélectrolytes anioniques comme inhibiteurs de nucléation dans leur modèle de minéralisation intrafibrillaire. Les polyélectrolytes anioniques peuvent imiter la conformation protéique hautement anionique et intrinsèquement désordonnée trouvée dans les protéines non collagènes. Dans le modèle proposé, les inhibiteurs de nucléation polyélectrolytiques liés au collagène reconstitué sans protéine de la matrice comme modèles de minéralisation intrafibrillaire. Song et al. ont d'abord simulé la dynamique moléculaire pour montrer qu'un polyélectrolyte tel que l'acide polyacrylique (PAA) pouvait réserver des complexes d'ions calcium et hydrogénophosphate en agrégats en forme de chaîne le long de la surface de la macromolécule lors de son introduction dans un milieu de minéralisation CaP sursaturé.
Sur la base de la dynamique moléculaire simulée, Song et al. a développé une hypothèse de test selon laquelle un inhibiteur de nucléation lié à la surface des fibrilles de collagène pourrait stabiliser les précurseurs de la minéralisation du CaP à proximité des fibrilles, pour une minéralisation intrafibrillaire efficace. Pour tester l'hypothèse, à la place, ils ont utilisé des témoins avec une version non liée du même polyélectrolyte utilisé pour stabiliser les précurseurs de CaP inclus dans le milieu de minéralisation.

Simulation de la phase tardive de la minéralisation intrafibrillaire du collagène HPAA. Rendu 3D de la phase tardive de la minéralisation intrafibrillaire du collagène HPAA montrant l'accumulation d'agrégats de clusters de prénucléation (jaune) le long de la surface des fibrilles ; les minéraux intrafibrillaires sont représentés en orange. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav9075.
Les scientifiques ont utilisé de l'acide polyacrylique de haut poids moléculaire - PAA (HPAA) pour simuler l'ostéopontine et du PAA de bas poids moléculaire (LPAA) pour simuler l'ostéocalcine. Ils ont réticulé chimiquement les électrolytes polyanioniques pour reconstituer des fibrilles ou des éponges de collagène de type I à l'aide de composés organiques et ont examiné la constitution du polymère à l'aide de la spectroscopie infrarouge à transformée de Fourier (FTIR). Song et al. ont utilisé la microscopie électronique à transmission (MET) pour observer les fibrilles de collagène liées au PAA qui étaient colorées en rouge et les ont enregistrées sous forme d'agrégats filamenteux denses aux électrons sur la surface des fibrilles. Ils ont ensuite utilisé la chromatographie liquide à haute performance pour examiner les caractéristiques de liaison/libération des éponges PAA-collagène.
Simuler la dynamique moléculaire de la biominéralisation
Pour comprendre les différentes phases de la minéralisation intrafibrillaire du collagène lié à l'HPAA (HPAA-collagène), les scientifiques ont créé des films en utilisant les données de tomographie électronique des diverses phases de la biominéralisation. Ils ont simulé la (1) phase précoce - pour montrer l'accumulation d'agrégats de clusters de prénucléation autour de la fibrille de collagène non minéralisée, (2) phase intermédiaire - pour montrer une minéralisation intrafibrillaire partielle et (3) phase tardive - pour montrer une minéralisation intrafibrillaire lourde des fibrilles de collagène HPAA. Ils ont montré que le LPAA-collagène n'induisait pas de minéralisation intrafibrillaire par rapport au HPAA dans l'étude, et n'a donc pas inclus les polymères dans les expériences ultérieures.

Simulations de dynamique moléculaire. (A) Profil des structures microfibrillaires nues de collagène avec des molécules d'eau dans les espaces intrafibrillaires. Rubans bleus, triples hélices de collagène; points rouges, molécules d'eau. (B) Vue latérale de microfibrilles de collagène nues. Les lignes bleues décrivent la boîte de simulation de 67 nm de long. (C et D) Mouvement de Ca2+ (sphères jaunes), HPO42− (ensembles rouges), et des précurseurs de minéralisation CaP assemblés (assemblages jaune-rouge) à travers les microfibrilles de collagène avec le HPAA (chaîne verte) lié aux acides aminés LYS1099 des molécules de collagène. (E) En haut :Simulation du mouvement de divers ions à travers les structures microfibrillaires HPAA-collagène à des moments de simulation désignés. Sphères bleues, sphères violettes, sphères jaunes, assemblage rouge, assemblages jaune-rouge, et la structure de la chaîne verte représente les ions Na+, ions Cl−, ions Ca2+, ions HPO42−, précurseurs de la minéralisation CaP, et HPAA, respectivement. En bas :Changements dynamiques du nombre de Ca2+ (ligne noire), HPO42− (ligne rouge), Na+ (ligne verte), et Cl− (ligne bleue) dans les régions intrafibrillaires et extrafibrillaires le long de la limite de l'axe a à 0, 30, 50, et 70 ns. (F) Mouvement de Ca2+, HPO42−, et assemblés précurseurs de minéralisation CaP à travers les microfibrilles de collagène nues avec HPAA non lié dans la région extrafibrillaire (témoin). (G) Comparaison de la distribution de divers ions dans la région intrafibrillaire dans les modèles de minéralisation HPAA liés au collagène et HPAA non liés. (H) Comparaison de l'écart quadratique moyen des molécules de collagène dans les modèles HPAA liés au collagène et les modèles HPAA non liés. (I) Comparaison de la surface accessible au solvant (SASA) des molécules de collagène entre les deux modèles. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav9075.
Song et al. par la suite, nous avons utilisé des simulations de dynamique moléculaire du processus de minéralisation pour comprendre la relation structure-fonction et validé la capacité des HPAA liés au collagène à agréger les précurseurs de la minéralisation CaP. Pour ça, ils ont utilisé un modèle atomistique complet du complexe fibrille HPAA-collagène hydraté. Dans le modèle unitaire, ils ont simulé Ca
2+
et HPO
Examen de l'ultrastructure
Pour les examens ultrastructuraux du modèle biomimétique, Song et al. ont utilisé la nanoindentation pour évaluer les modules de Young des fibrilles de collagène minéralisées et non minéralisées par microscopie à force atomique (AFM). Les valeurs étaient similaires à celles précédemment rapportées pour les fibrilles minéralisées et non minéralisées, calculé par nanoindentation. Les scientifiques ont utilisé la spectroscopie de diffraction des rayons X pour identifier la présence d'apatite sur les éponges minéralisées. L'étude a montré que le collagène HPAA minéralisé dans une solution de CaP pendant sept jours avait une teneur en minéraux plus élevée que le collagène nu. Lorsque Song et al. calculé le rapport apatite/collagène dans les profils spectroscopiques, les éponges de collagène HPAA ont indiqué des niveaux plus élevés de minéralisation.
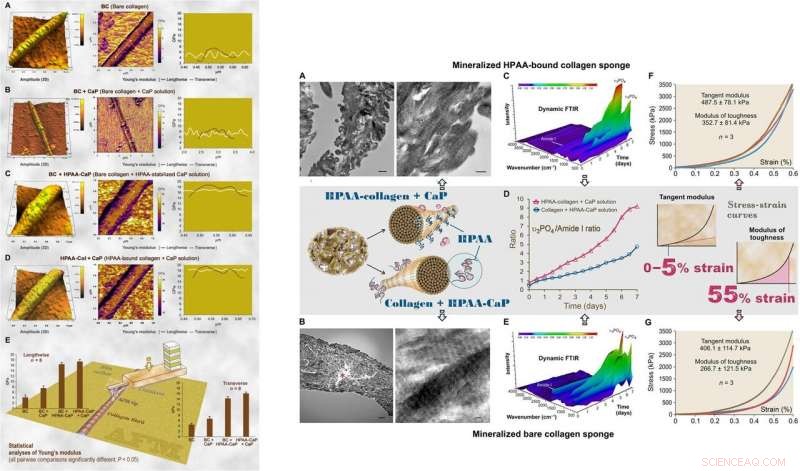
:GAUCHE :AFM de la topographie de surface 3D et cartographie du module d'élasticité (module de Young) de l'air séché représentatif, collagène nu minéralisé et fibrilles de collagène HPAA. (A) Les fibrilles de collagène nues (BC) avaient une distribution proche de la normale du module de Young transversalement à travers la fibrille. (B) Collagène nu minéralisé dans une solution de CaP sans inhibiteur de nucléation (BC + CaP). (C) Collagène nu minéralisé avec une solution HPAA-CaP (BC + HPAA-CaP). (D) HPAA-collagène minéralisé avec une solution de CaP sans inhibiteur de nucléation (HPAA-Col + CaP). (E) Analyses statistiques du module de Young de la fibrille de collagène dans les directions longitudinale et transversale (n =8). DROITE :Caractérisation d'éponges de collagène HPAA minéralisées et d'éponges de collagène nues. (A) TEM d'éponges de collagène HPAA minéralisées. (B) TEM d'éponges de collagène nu minéralisées. (C) La réflexion totale atténuée dynamique (ATR)-FTIR montre une minéralisation progressive d'une éponge de collagène HPAA à des intervalles de 12 heures sur une période de 7 jours. (D) Modifications du rapport apatite υ3PO4/amide de collagène I des éponges de collagène anioniques minéralisées et des éponges de collagène non modifiées. E) ATR-FTIR dynamique montre la progression de la minéralisation d'une éponge de collagène nue dans une solution HPAA-CaP. (F) Réponse contrainte-déformation des éponges de collagène HPAA minéralisées pour déterminer le module tangent et le module de ténacité (encart, rangée du milieu). (G) Réponse de contrainte-déformation d'éponges de collagène nu minéralisées. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aav9075.
Le module de ténacité, qui indique typiquement l'énergie par unité de volume qu'un matériau peut absorber avant de se rompre, était également significativement plus élevée pour les éponges de collagène HPAA, indiquant une résistance à la rupture du matériau. De telles caractéristiques expliquent la haute résilience des tissus à base de collagène biominéralisé qui imitent la microarchitecture osseuse pour combiner les propriétés osseuses de ténacité et de résistance dans l'ingénierie régénérative. Song et al. crédité les propriétés observées de cohésion/adhérence à la réticulation HPAA, qui a permis de créer le composite collagène/minéral, similaire à l'ostéopontine réticulée trouvée dans l'architecture osseuse.
Applications des nouvelles constructions biocompatibles
Étant donné que la biocompatibilité des nouveaux matériaux est une caractéristique importante de la science des matériaux et de la bio-ingénierie, Song et al. vérifié les interactions favorables entre le matériel cellulaire et le collagène réticulé par HPAA en utilisant la viabilité et la prolifération des cellules souches pendant la culture cellulaire de régénération osseuse en laboratoire. Lorsque les scientifiques ont effectué des tests de déshydrogénase mitochondriale et d'apoptose sur des cellules souches mésenchymateuses humaines, ils n'ont pas observé de différences significatives entre les éponges de collagène HPAA non minéralisées et nues. En raison de leur compatibilité avec les cellules humaines de type ostéoblaste, de tels matériaux peuvent être utilisés comme revêtements biocompatibles pour implants chirurgicaux.
De cette façon, Song et al. a démontré un modèle biomécanique d'amélioration de la minéralisation intrafibrillaire en utilisant des interactions collagène-ligand pour comprendre les mécanismes spécifiques au site. Ce modèle d'interactions collagène-ligand peut également éclairer les causes potentielles de la minéralisation ectopique, qui intéresse actuellement. Dans la perspective de Song et al., la minéralisation intrafibrillaire via les interactions collagène-ligand peut infiltrer les minéraux de manière plus cohérente dans les matrices de collagène en vrac pour des applications en médecine régénérative. Les résultats permettront de comprendre les propriétés biomécaniques, tout en réduisant les défauts pour augmenter les caractéristiques biomimétiques d'une matrice de collagène minéralisé en ingénierie tissulaire.
© 2019 Réseau Science X