Selon une nouvelle étude, l'association de nanoparticules d'oxyde de fer avec du peroxyde d'hydrogène permet d'obtenir un traitement ciblé avec précision pour tuer les bactéries buccales nocives, décomposer la plaque dentaire et même diagnostiquer les biofilms oraux nocifs. Crédit :avec l'aimable autorisation des auteurs de l'étude
Un nombre croissant de preuves indique un lien entre l'anémie ferriprive et la carie dentaire sévère. On ne sait pas si le lien est corrélatif ou causal, bien que les deux conditions soient associées à une mauvaise alimentation et soient plus fréquentes chez les personnes vivant dans des environnements pauvres et avec des conditions médicales sous-jacentes.
Maintenant, des recherches de l'Université de Pennsylvanie, en collaboration avec l'Université de l'Indiana, suggèrent qu'une thérapie approuvée par la FDA pour l'anémie ferriprive est également prometteuse pour le traitement, la prévention et même le diagnostic de la carie dentaire. Le traitement, une combinaison d'une solution contenant des nanoparticules d'oxyde de fer appelée ferumoxytol et de peroxyde d'hydrogène, a été appliqué sur de l'émail dentaire réel placé dans un appareil semblable à une prothèse dentaire et porté par les sujets de l'étude.
L'étude, publiée dans la revue Nano Letters , ont découvert qu'une application deux fois par jour de ferumoxytol, qui activait le peroxyde d'hydrogène contenu dans un rinçage de suivi, réduisait considérablement l'accumulation de plaque dentaire nocive et avait un effet ciblé sur les bactéries largement responsables de la carie dentaire. Ces types de nanoparticules aux propriétés enzymatiques sont parfois appelées "nanozymes" et sont de plus en plus explorées pour leur potentiel dans les applications biomédicales et environnementales.
"Nous avons constaté que cette approche est à la fois précise et efficace", déclare Hyun (Michel) Koo, professeur à l'École de médecine dentaire de l'Université de Pennsylvanie. "Il perturbe les biofilms, en particulier ceux formés par Streptococcus mutans , qui causent des caries, et il a également réduit l'étendue de la dégradation de l'émail. Il s'agit de la première étude à notre connaissance réalisée dans un cadre clinique qui démontre la valeur thérapeutique des nanozymes contre une maladie infectieuse."
Le travail est une extension d'un article de 2018 publié dans Nature Communications , dans laquelle Koo et ses collègues, dont David Cormode de la Perelman School of Medicine de Penn, ont montré que le traitement par nanoparticules d'oxyde de fer et peroxyde d'hydrogène pouvait empêcher l'accumulation de biofilm et la carie dentaire dans un modèle expérimental et un modèle animal.
Dans les travaux en cours, les scientifiques ont voulu franchir la prochaine étape logique, en travaillant chez l'homme. Dans une étude randomisée, ils ont demandé à 15 participants d'utiliser un appareil amovible semblable à une prothèse avec de l'émail dentaire réel attaché, une méthode développée et largement testée par Domenick T. Zero de l'Université de l'Indiana, co-auteur correspondant de l'article actuel.
Les participants à l'étude ont appliqué une solution contenant du sucre sur l'appareil quatre fois par jour, imitant les repas et les collations riches en sucre consommés au cours de la vie quotidienne. On a demandé aux participants de ne pas brosser les échantillons d'émail mais plutôt de rincer l'appareil deux fois par jour. Les participants ont été divisés en trois groupes, un utilisant le ferumoxytol puis le rinçage au peroxyde d'hydrogène, un avec une solution apportant les ingrédients inactifs du ferumoxytol et un troisième avec de l'eau seule.
Après 14 jours, les chercheurs ont analysé les biofilms qui se sont accumulés sur les échantillons d'émail. Ils ont découvert que le traitement expérimental réduisait puissamment la croissance des biofilms contenant du S. mutant et pourrait tuer cette bactérie avec une grande spécificité. Les autres bactéries commensales normalement présentes dans la bouche n'ont pas été affectées par le traitement au ferumoxytol-peroxyde d'hydrogène.
Les résultats et la sécurité de l'approche ont été étayés par des travaux antérieurs, qui ont montré que les nanoparticules d'oxyde de fer ne se lient pas au tissu muqueux de la bouche et ne provoquent pas de cytotoxicité ou de modifications du microbiome oral dans un modèle animal.
"Ce traitement ne semble pas avoir d'effets nocifs et hors cible", déclare Koo.
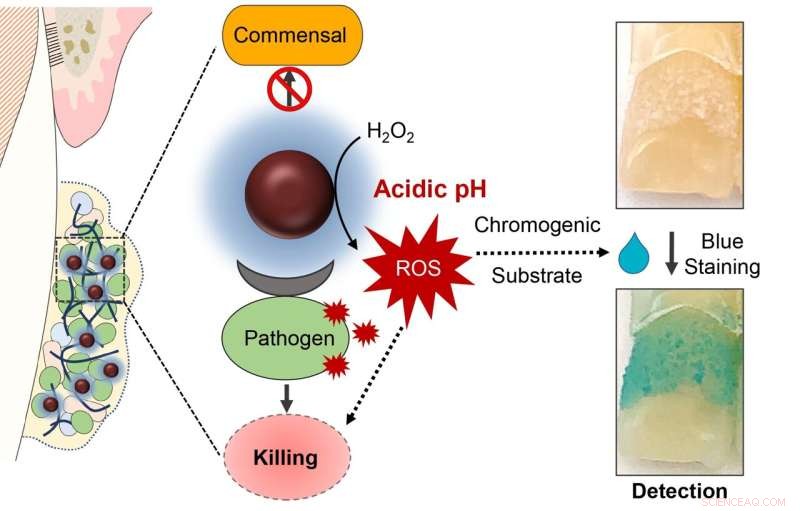
La raison de cette précision est triple. La réaction pour catalyser le peroxyde d'hydrogène ne se produit que dans un environnement très acide, comme ce qui se produit lorsque des bactéries causant des caries sont présentes et actives. Le traitement provoque également la décomposition de la matrice collante des glucides, dégradant le biofilm et exposant les microbes. Et le ferumoxytol peut se lier spécifiquement aux récepteurs du S. mutant membrane cellulaire, facilitant sa destruction.
Dans une dernière étape de l'étude, les chercheurs ont ajouté un marqueur qui vire au bleu lorsqu'il est exposé à des espèces réactives de l'oxygène, comme celles générées par la catalyse du peroxyde d'hydrogène par des nanoparticules de ferumoxytol. Et en effet, l'équipe a découvert que l'intensité du marquage bleu correspondait à des biofilms acides contenant du S. mutant .
En raison de cette capacité de "détection", Koo note que le traitement expérimental a le potentiel de devenir ce qu'on appelle un "théranostic", c'est-à-dire un médicament qui peut être utilisé à la fois pour diagnostiquer une maladie et la traiter. "Il peut également être utilisé à la maison", explique Koo. "Vous pouvez rincer avec, voir la quantité de plaque causant la carie, puis traiter avec la solution ou consulter un dentiste pour un traitement de suivi." La plaque dentaire n'est pas à la hauteur des nanoparticules catalytiques