
Technique de nanoendoscopie-AFM 3D. (A) Schéma de la méthode de nanoendoscopie-AFM 3D, où la nanosonde est introduite à plusieurs reprises à l'intérieur de la cellule à différentes positions dans la zone souhaitée. (B) Nanosonde fabriquée par FIB utilisée dans les mesures de nanoendoscopie-AFM 3D. (C et D) Courbes F-z typiques obtenues en pénétrant dans une cellule, où une diminution brutale de la déviation en porte-à-faux est représentée comme un pic lorsque la nanosonde pénètre dans la membrane cellulaire externe (C), apparaissant comme un autre pic au cas où la nanosonde perce la membrane nucléaire (RÉ). (G) Carte cellulaire nanoendoscopie-AFM 3D de l'ensemble du volume cellulaire HeLa (40 × 40 × 6 μm3) enfermé dans le carré rouge en (E), où la membrane cellulaire, le noyau et les régions cytoplasmiques peuvent être distingués dans la section transversale affiché en (H). (I) Image nanoendoscopie-AFM 3D d'un volume de cellules HeLa (10 × 10 × 6 μm3) enfermé dans le carré rouge en (F), où les structures granulaires internes peuvent être clairement reconnues. Crédit :Progrès scientifiques , 10.1126/sciadv.abj4990
La microscopie à force atomique (AFM) offre une méthode d'imagerie sans étiquette de la dynamique biomoléculaire à l'échelle nanométrique pour résoudre des questions biologiques qui ne peuvent être résolues par d'autres méthodes de bioimagerie, notamment la fluorescence et la microscopie électronique à balayage. Comme de telles méthodes d'imagerie ne sont possibles que pour des systèmes biologiques extraits de cellules ou reconstruits sur des substrats solides, la nanodynamique au sein des cellules vivantes reste largement inaccessible avec les méthodes de bioimagerie existantes. Dans un nouveau rapport maintenant publié dans Science Advances , Marcos Penedo et une équipe de recherche en Nanolife Science et biotechnologie à l'Université de Kanazawa au Japon, ont dépassé les limites de la bioimagerie en utilisant la nanoendoscopie-AFM. Au cours du processus, ils ont inséré une sonde en forme d'aiguille dans une cellule vivante pour présenter la fibre d'actine, des cartes tridimensionnelles (3D) et la nanodynamique 2D de l'échafaudage interne de la membrane avec des changements indétectables dans la viabilité cellulaire. Contrairement aux méthodes AFM antérieures, la nanosonde a directement accédé aux composants intracellulaires cibles et a exploré les capacités de l'AFM, y compris l'imagerie haute résolution, la cartographie nanomécanique et la reconnaissance moléculaire pour élargir la gamme observable des structures intracellulaires dans les cellules vivantes.
Dynamique intracellulaire en bioimagerie
La dynamique à l'échelle moléculaire des composants intracellulaires donne un aperçu des mécanismes fondamentaux des fonctions cellulaires et de la maladie. Cependant, les méthodes d'imagerie directe pour une telle nanodynamique dans les cellules vivantes sont difficiles. Par exemple, alors que la microscopie électronique est utile pour imager des nanostructures de cellules congelées dans le vide, elles sont incapables d'imager la nanodynamique dans des cellules vivantes dans des environnements physiologiques, sauf sous forme d'instantanés statiques de conformations fixes. De même, alors que la microscopie à fluorescence via le marquage par fluorescence fournit une méthode puissante pour visualiser la dynamique des protéines et des organites dans les cellules vivantes, elles sont limitées par une incapacité à imager efficacement à l'échelle nanométrique. Il existe donc de fortes demandes pour une méthode d'imagerie intracellulaire sans étiquette dans des environnements liquides. La microscopie à force atomique (AFM) est un candidat potentiel pour le rôle avec la capacité d'imager à l'échelle sub-nanométrique pour visualiser la nanodynamique des lipides, des protéines et des ADN sans marqueurs. Cependant, de telles images ne sont pas représentatives de systèmes biologiques résultant d'une extraction à partir d'une cellule ou d'une reconstruction sur un substrat solide in vitro. Dans ce travail, donc, Penedo et al. a proposé une méthode d'imagerie basée sur l'AFM connue sous le nom de nanoendoscopie-AFM pour observer la nanodynamique à l'intérieur des cellules vivantes sans les étiqueter ni les briser.
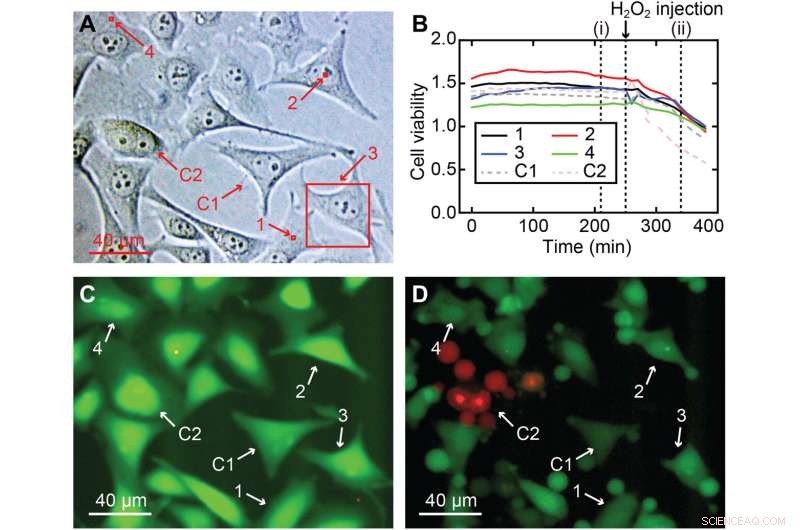
Viabilité cellulaire des mesures de nanoendoscopie-AFM 3D. (A) Différentes zones mesurées réalisées dans une culture de cellules HeLa pour le test de viabilité cellulaire, y compris les régions du noyau et de la périphérie cellulaire :(1) 2 × 2 × 7 μm3, (2) 2 × 2 × 10 μm3, (3) 40 × 40 × 8 μm3 et (4) 2 × 2 × 7 μm3, mis en évidence dans des carrés rouges ; deux cellules ont été utilisées comme contrôle, C1 et C2. (B) Rapports de viabilité cellulaire au fil du temps pour les quatre cellules imagées (1 à 4) et pour les deux cellules utilisées comme contrôle (C1 et C2), montrant que toutes les cellules (imagées et contrôle) avaient une intensité de viabilité cellulaire plate similaire rapport et confirmant que les cellules n'étaient pas très endommagées. (C) Exemple d'une image de fluorescence après 210 min correspondant à (i) dans (B), où la forte couleur verte signifie une activité estérase normale attendue pour une cellule vivante. Pour vérifier la validité du test, H2O2 a été ajouté après 260 min au milieu pour tuer les cellules, ce qui a entraîné une diminution des rapports de viabilité cellulaire de toutes les cellules, une indication claire que les cellules mouraient. (D) Instantané de fluorescence correspondant au temps (ii) en (B), où des signes de dommages sont clairement visibles dans toutes les cellules, dont la plupart ont déjà subi un rétrécissement ou une apoptose. Crédit :Progrès scientifiques , 10.1126/sciadv.abj4990
Expériences de nanoendoscopie-AFM
Au cours des expériences, un peu comme une caméra endoscopique, les chercheurs ont inséré une longue nanosonde en forme d'aiguille à l'intérieur d'une cellule vivante pour effectuer une imagerie AFM 2D et 3D. L'équipe a montré comment la nanoendoscopie-AFM offrait un avantage unique pour l'imagerie de cellules vivantes intracellulaires sans étiquette à l'échelle nanométrique. La méthode fournit une voie puissante pour observer des phénomènes jusqu'ici inexplorés dans les systèmes biologiques. Penedo et al. introduit à plusieurs reprises la nanosonde à l'intérieur de la cellule à différentes positions de la zone souhaitée via des mesures de courbe de force en fonction de la distance. Afin d'imager la cellule entière, la nanosonde devait être suffisamment longue pour pénétrer complètement dans la cellule jusqu'à ce qu'elle atteigne le substrat, et avec des diamètres inférieurs à 200 nm pour minimiser les dommages cellulaires, tout en facilitant la pénétration de la membrane. L'équipe a utilisé une pointe tétraédrique en silicium commerciale comme nanosonde, qu'elle a broyée à l'aide d'un broyage par faisceau d'ions focalisé aux dimensions préférées. L'équipe a ensuite utilisé les nanosondes dans différentes zones d'une cellule HeLa. Ils ont acquis une image nanoendoscopie-AFM 3D d'une cellule entière au cours des expériences et ont identifié le noyau de la cellule HeLa du reste de la cellule. D'autres mesures ont également indiqué les structures granulaires internes. Pour minimiser les dommages cellulaires lors de la pénétration, Penedo et al. réduit autant que possible la force de pénétration et la longueur d'indentation. Ils ont également mené des expériences de viabilité cellulaire pour confirmer que la nanoendoscopie-AFM 3D n'entraînait pas de dommages cellulaires graves lors de l'utilisation de nanosondes d'un diamètre inférieur à 200 nm. À l'aide de la nanoendoscopie-AFM 3D, ils ont facilité l'imagerie du cytosquelette interne dans les cellules vivantes pour observer l'organisation 3D des fibres non supportées. L'équipe a également fusionné avec succès des images intracellulaires issues de la nanoendoscopie-AFM 3D et de la microscopie confocale.

Combinaison d'imagerie confocale et de nanoendoscopie 3D-AFM. (A) Image de fluorescence confocale où les filaments d'actine colorés sont visibles. (B) L'image agrandie obtenue à la zone indiquée par le carré rouge en (A). (C et D) Cartes nanoendoscopie-AFM 3D des fibres d'actine du cytosquelette obtenues dans la zone mise en évidence par le carré rouge en (B), où les positions verticales Z des différents filaments d'actine (flèches rouges) et les membranes cellulaires supérieures et inférieures sont simultanément résolus. L'image semi-transparente montrée dans le carré rouge en (B) correspond à la projection 2D des cartes 3D montrées en (C) et (D). Crédit :Progrès scientifiques , 10.1126/sciadv.abj4990
Nanoendoscopie-AFM 2D
La possibilité d'insérer plusieurs fois une longue nanosonde dans une cellule tout en maintenant la viabilité cellulaire impliquait la possibilité de localiser l'apex de la sonde dans une cellule vivante pour effectuer des mesures AFM 2D/3D locales sans dommages substantiels. La nanosonde pourrait être insérée dans la cellule pour mesurer le côté cytoplasmique de la membrane cellulaire via le mode de modulation d'amplitude AFM. Les nanosondes devaient être suffisamment longues pour pénétrer complètement dans la cellule et atteindre son fond, tout en étant suffisamment fines pour réduire les dommages cellulaires. Pour y parvenir en pratique, Penedo et al. ont développé des nanosondes en carbone amorphe en utilisant le dépôt par faisceau d'électrons et ont mesuré la dépendance de l'amplitude à la distance, pour déterminer l'intégrité de la cellule. Ils ont réalisé des expériences de nanoendoscopie-AFM 2D en utilisant une cellule de fibroblaste pour illustrer la structure réticulaire de la membrane cellulaire interne et ont observé l'architecture cellulaire pour étudier la dynamique interne des structures cellulaires. Les travaux ont mis en évidence la possibilité d'utiliser la nanoendoscopie-AFM 2D pour étudier la nanodynamique des structures internes des cellules vivantes dans des environnements physiologiques.

Technique de nanoendoscopie-AFM 2D. (A) Illustration de la méthode de nanoendoscopie-AFM 2D, où la nanosonde est insérée à l'intérieur de la cellule pour mesurer le côté cytoplasmique de la membrane cellulaire par mode de modulation d'amplitude AFM. (B) Exemple d'une nanosonde fabriquée par EBD utilisée dans la nanoendoscopie-AFM 2D, où la longueur de l'aiguille doit être suffisamment longue pour pénétrer complètement dans la cellule et atteindre sa partie inférieure et suffisamment mince pour réduire les dommages cellulaires. (C) Force enregistrée (en haut) et amplitude (en bas) en fonction des courbes de distance pour localiser précisément les membranes cellulaires supérieure et inférieure :la force verticale est nulle lorsque la nanosonde est éloignée, augmentant dès que la nanosonde touche la membrane cellulaire supérieure; ensuite, il présente un plateau qui correspond au domaine cytoplasmique interne jusqu'à ce que la courbe augmente à nouveau fortement lorsque la nanosonde atteint la membrane cellulaire inférieure. Le point de consigne d'amplitude pour la régulation de la distance pointe-échantillon doit être suffisamment bas pour garantir que la pointe touche la surface inférieure de la cellule. (F) Images consécutives de nanoendoscopie-AFM 2D 1 μm × 1 μm réalisées sur un fibroblaste BALB / 3T3 sur la région mise en évidence par le point rouge représenté en (D), montrant la structure réticulaire de la surface interne de la membrane cellulaire formant son échafaudage ainsi que les fluctuations de la membrane lors des mesures. (G) Zone agrandie des images affichées en (F), traçant une section entre les points A et B (E), où deux saillies séparées de 25 nm sont clairement résolues dans l'image. Crédit :Progrès scientifiques , 10.1126/sciadv.abj4990
Perspectives
De cette façon, Marcos Penedo et ses collègues ont montré les applications de la nanoendoscopie-AFM pour mesurer les surfaces internes cytoplasmiques des membranes cellulaires et des échafaudages associés afin de comprendre l'arrangement 3D des filaments d'actine dans leur environnement intracellulaire naturel dans les cellules vivantes. L'équipe a cherché à minimiser les dommages cellulaires en utilisant des nanosondes ultrafines en forme d'aiguille dans les expériences. Les méthodes AFM proposées ont produit des cartes 3D des structures cellulaires internes en plus des projections 2D combinées aux méthodes de fluorescence existantes telles que la microscopie confocale ou à super-résolution. La méthode permettra d'éclairer la machinerie cellulaire en action, in vivo, tout en exposant des moteurs moléculaires physiologiques. La méthode ouvrira également de nouvelles possibilités pour étudier la nanomécanique intracellulaire qui joue un rôle important dans les fonctions cellulaires. L'équipe peut utiliser la méthode pour mesurer les caractéristiques de rigidité, d'adhérence et de dissipation du noyau afin d'extraire des informations biologiques adaptées aux domaines interdisciplinaires de la biologie cellulaire et de la médecine.
© 2022 Réseau Science X Une nouvelle méthode d'imagerie donne un aperçu en direct du fonctionnement des cellules