
Fig. 1. Illustration schématique d'un sac enfermé dans une membrane à trois zones, formé lorsqu'une goutte de HA en solution tombe dans une solution de PA. La couche la plus interne (1) est un gel de molécules de HA. Il est entouré d'une couche de nanofibres disposée tangentiellement à la surface du sac (2), d'où émergent perpendiculairement des nanofibres (3).
Les techniques de création de matériaux nanostructurés complexes par auto-assemblage de molécules sont devenues de plus en plus sophistiquées. Mais porter ces techniques dans le domaine biologique a été problématique. Récemment, des scientifiques de la Northwestern University ont utilisé l'auto-assemblage dans des conditions contrôlées pour créer une membrane composée de couches avec des structures nettement différentes. Maintenant, travaillant à la source avancée de photons (APS) du département américain de l'Énergie, l'équipe a utilisé la diffusion des rayons X aux petits angles (SAXS) pour mieux déterminer ces structures et étudier leur formation. Ces nouvelles informations ouvrent la voie à la conception et à la synthèse de structures hiérarchiques avec des applications biomédicales.
Les amphiphiles peptidiques (PA) sont des chaînes d'acides aminés complétées par d'autres molécules de sorte qu'une extrémité soit hydrophile (se mélange bien à l'eau) et l'autre hydrophobe (n'aime pas l'eau). En solution aqueuse, Les PA forment longtemps, de fines nanofibres lorsque les chaînes d'acides aminés se lient aux chaînes adjacentes pour former des feuillets β. Les scientifiques de la Northwestern University avaient précédemment découvert que lorsqu'une solution aqueuse contenant des AP chargés positivement était mise en contact avec une solution aqueuse d'acide hyaluronique chargé négativement (HA - une grande molécule biologique qui se produit dans les tissus conjonctifs et autres), un dense, couche fibreuse formée en quelques millisecondes, créant une barrière qui empêchait les deux solutions de se mélanger.
Plus précisément, les chercheurs ont découvert que la couche fibreuse empêche les AP agrégés de migrer vers le côté HA, mais permet aux molécules HA de s'insinuer lentement à travers la barrière du côté PA, sur une échelle de temps de quelques minutes ou plus.
Le résultat était une structure membranaire à trois zones :une couche de type gel sur le côté HA, un tapis fibreux constitué de nanofibres de PA se trouvant dans le plan de l'interface entre les solutions, et un revêtement de fibres dirigé perpendiculairement à l'opposé de l'interface et formé par des complexes liés électrostatiquement de PA et HA (Fig. 1).
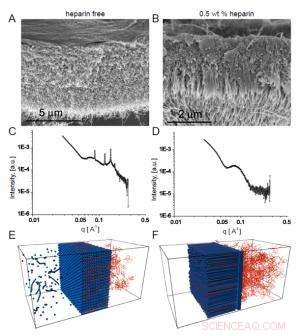
Fig. 2. Les micrographies électroniques à balayage montrent la membrane homogène qui se forme en l'absence d'héparine (A), tandis qu'en présence d'héparine se forme une structure fibreuse transversale à la membrane (B).
L'intérêt de l'équipe pour ces membranes reposait sur d'éventuelles utilisations biomédicales dans lesquelles la séquence peptidique formant les nanofibres aurait une activité biologique choisie. Dans un exemple, ils ont incorporé une séquence de liaison à l'héparine pour favoriser l'angiogenèse (la formation de nouveaux vaisseaux sanguins), afin que la membrane puisse aider à la réparation des tissus. Pour que la structure à trois zones se forme, les chercheurs ont découvert que la solution de HA devait contenir de l'héparine dans une certaine plage de concentration. La microscopie électronique à balayage a clairement montré une structure linéaire traversant la membrane qui s'est formée lorsque l'héparine était présente à 0,5% en poids (Fig. 2a), contrairement à l'aspect plus homogène de la membrane créée en l'absence d'héparine (Fig. 2b).
Les scientifiques se sont tournés vers SAXS sur la ligne de lumière 5-ID-D de l'équipe d'accès collaboratif DuPont-Northwestern-Dow à l'APS d'Argonne, une installation utilisateur du Bureau des sciences. Ces études donnent un aperçu de la structure précise des membranes à trois zones et une meilleure compréhension de la dynamique de leur formation.
Les membranes sans héparine ont produit des pics de Bragg bien définis, contrairement aux membranes à trois zones. De plus, les membranes apparues en présence de concentrations d'héparine plus faibles présentaient des pics de Bragg plus importants que ceux produits lorsque la concentration d'héparine était plus élevée, indiquant une compétition entre deux structures dont l'issue dépendait des taux d'héparine.
Une série chronologique de mesures SAXS sur une expérience sans héparine a montré que les pics de Bragg ont commencé à se former quelques minutes après la mise en contact des deux solutions, et atteint sa pleine puissance après environ 45 minutes.
Interpréter les résultats du SAXS à la lumière de leurs expériences précédentes et des propriétés connues des PA et HA, les scientifiques expliquent les différences entre les deux types de membranes comme le résultat de différents types d'agrégation. En l'absence d'héparine, le PA et le HA se réunissent dans des agrégats nanosphériques qui s'entassent dans un arrangement cubique, sur une durée de quelques dizaines de minutes, pour former une membrane qui génère des pics de Bragg bien définis.
Lorsque l'héparine est présente, par contre, il se lie fortement au PA et modifie son interaction avec les molécules d'AH. Dans ce cas, une barrière de nanofibres parallèle à l'interface de la solution se forme immédiatement, agit alors comme une barrière de diffusion à travers laquelle HA passe lentement. Comme il émerge de l'autre côté, il se lie au PA pour former des nanofibres qui se développent perpendiculairement à l'interface. Ce réseau de nanofibres ordonné ne produit aucun pic de Bragg.
La compréhension et le contrôle accrus de ces processus issus de cette recherche pourraient permettre de construire des membranes bioactives avec une variété de structures et d'objectifs.