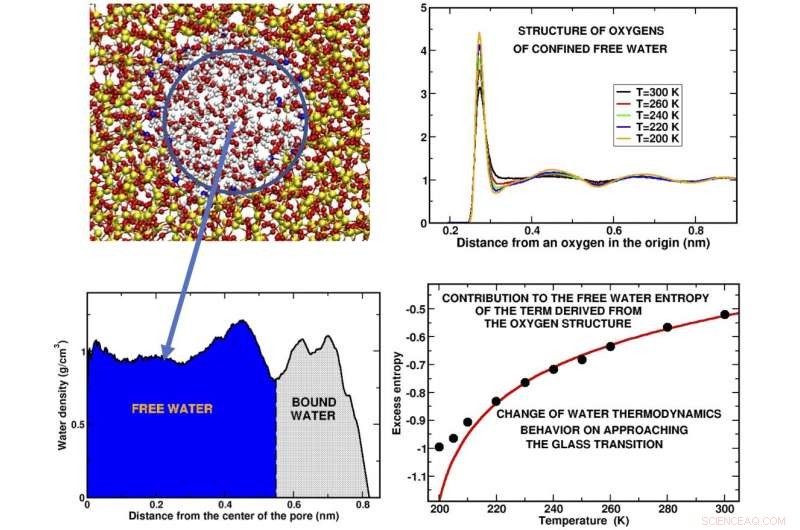
Panneau supérieur gauche :Instantané d'une tranche d'eau confinée dans le pore de silice. Le cercle bleu contient "l'eau libre, ' les molécules d'eau qui ne sont pas en contact avec le substrat.Panneau inférieur gauche :Profil de densité des molécules d'eau le long du rayon des pores. Les régions occupées respectivement par l'eau libre et "l'eau liée, " l'eau attachée au substrat, sont indiqués.Panneau supérieur droit :Les courbes représentent comment les atomes d'oxygène des molécules sont disposés dans des coquilles autour d'un atome d'oxygène donné à l'origine à différentes températures. Les pics représentent les positions où se trouvent les différentes coquilles. La structure est montrée pour certaines des températures de surfusion étudiées. Panneau inférieur droit :Le résultat principal de notre simulation informatique est donné par le comportement de l'excès d'entropie, une fraction de l'entropie totale, obtenu à partir de la structure oxygénée de l'eau libre. L'écart des points noirs calculés par rapport à la courbe théorique (rouge) indique que l'eau subit un changement de comportement avant et à l'approche de la transition vitreuse. Crédit :Margherita De Marzio, Gaïa Camisasca, Maria Martin Condé, Mauro Rovere et Paola Gallo
Il y a peu de choses plus essentielles à la vie sur terre que l'eau. Il domine le paysage physique, couvrant une grande partie de la planète comme les océans. C'est aussi un composant majeur du corps humain, comprenant, par exemple, plus de 70 % de la masse d'un nouveau-né.
Pourtant, malgré son omniprésence, l'eau a de nombreuses propriétés physiques qui ne sont pas encore complètement comprises par la communauté scientifique. L'une des plus déroutantes concerne l'activité des molécules d'eau après qu'elles aient subi un processus appelé « surfusion ».
Maintenant, nouvelles découvertes de l'Université de Roma Tre, à Rome, Italie, sur les interactions des molécules d'eau dans ces conditions exotiques apparaissent cette semaine dans le Journal de physique chimique .
"Normalement, lorsque l'eau liquide est refroidie en dessous de son point de congélation, les molécules d'eau s'arrangent dans l'ordre, structure cristalline qui est la glace, " dit Paola Gallo, professeur agrégé de physique à l'Université de Roma Tre. "Avec la surfusion, des techniques spéciales sont utilisées pour refroidir l'eau très rapidement de manière à ce qu'elle reste liquide même si sa température a été abaissée bien en dessous de son point de congélation. Il existe un certain nombre d'anomalies dans l'activité des molécules d'eau dans ces conditions de surfusion qui n'ont pas encore été complètement expliquées."
A l'aide d'une simulation informatique, Gallo et ses collègues ont mis en lumière une propriété thermodynamique de l'eau qui aide à expliquer comment les molécules d'eau à l'état de surfusion interagissent les unes avec les autres et avec les molécules d'autres matériaux.
« Alors que la surfusion est un phénomène important à étudier, le défi est qu'il est très difficile de surfusionner de l'eau dans un laboratoire, " dit Gallo.
Autrefois, les scientifiques ont tenté de résoudre ce problème en surrefroidissant l'eau « en confinement, " concentrer les efforts sur l'étude de l'eau confinée dans des pores manufacturés ayant un rayon de quelques namomètres (c'est-à-dire un ou deux ordres de grandeur plus grand que le diamètre de la molécule d'eau). Ceci, cependant, a soulevé la question de savoir si les propriétés de cette eau confinée diffèrent de celles de l'eau en vrac, où les molécules d'eau interagissent librement dans des volumes plus importants.
« Cette question a été un point d'intérêt constant dans notre travail, " a déclaré Gallo. " Dans les études précédentes, nous avons montré que les interactions avec d'autres produits chimiques n'affectent que les molécules d'eau qui sont physiquement très proches des molécules d'un autre produit chimique, comme les molécules qui composent la paroi du pore. Les molécules d'eau au centre du pore, l'eau gratuite, conservent bon nombre des propriétés de l'eau en vrac.
"Avec cette étude, nous avons découvert qu'il existe d'autres parallèles, " Gallo a également dit. " Plus précisément, notre simulation montre qu'une propriété de la structure du réseau de molécules d'eau, qui peut être mesuré et vérifié expérimentalement, peut être utilisé pour déterminer les changements dans l'entropie de l'eau, la quantité thermodynamique qui mesure le désordre dans un système [...] qui peut offrir des informations sur certaines des facettes thermodynamiques les plus inhabituelles de l'activité de l'eau dans cet état de surfusion."
Ces résultats créent un cadre permettant à d'autres physiciens expérimentaux de recréer la simulation avec des échantillons physiques dans un laboratoire. Pour Gallo et ses collègues, leur travail offre une base pour une enquête plus approfondie sur les relations entre les caractéristiques thermodynamiques de l'eau confinée et en vrac.
"L'eau est le liquide le plus important que nous ayons sur terre, " a expliqué Gallo. " Toutes les informations que les chercheurs peuvent découvrir sur ses propriétés peuvent faire progresser non seulement notre compréhension collective de la physique, mais aussi de biologie et de chimie, et ouvrir de nouvelles possibilités d'intégration de ces connaissances dans différentes applications technologiques."