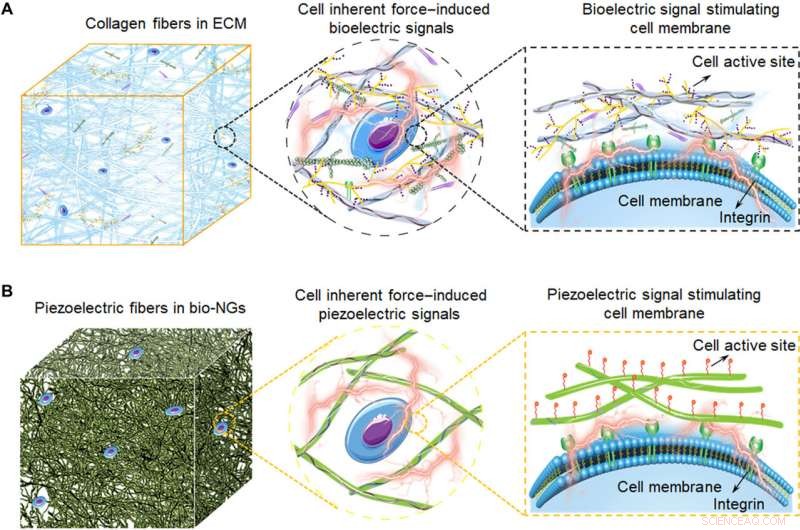
Illustrations schématiques de bio-NGs de couplage électromécanique modulant l'activité cellulaire inspirées de l'ECM. (A) Les fibres de collagène dans l'ECM convertissant la force inhérente à la cellule en bioélectricité, qui constitue également l'architecture 3D d'ECM. Ces signaux bioélectriques sont transmis par des molécules de signal remplies entre les fibres de collagène, Donc, pour réguler l'activité cellulaire et réaliser l'expression fonctionnelle des cellules. (B) Schéma de principe des fibres piézoélectriques bioinspirées dans les bio-NG. L'interaction des cellules avec les bio-NGs émulant ce signal bioélectrique dans l'ECM induit, en réponse aux forces inhérentes produites par les cellules, un champ électrique local qui stimule et module leur activité cellulaire. Crédit :Avancées scientifiques, 10.1126/sciadv.abh2350
L'espace 3D unique au sein des bio-NG a fourni un environnement de type ECM pour favoriser la croissance cellulaire. Les bio-NG ont efficacement favorisé la viabilité et le développement cellulaires pour maintenir son expression fonctionnelle spécifique. Les chercheurs s'attendent à ce que les bio-NG nouveaux et avancés imitent la complexité de la matrice extracellulaire et fournissent un système biologique in vivo physiologiquement pertinent. Le dispositif a efficacement favorisé la viabilité et le développement cellulaires pour maintenir son expression fonctionnelle spécifique. Li et al. attendez-vous à ce que la nouvelle version avancée des bio-nanogénérateurs fournisse un système biologique in vivo physiologiquement pertinent pour remplacer les systèmes 2D et les modèles animaux inexacts.
Guide pour les cellules
Dans ce travail, Li et al. a décrit une stratégie pratique pour la stimulation électrique sans fil des cellules et des tissus afin de réparer et de maintenir la fonction cellulaire. La bioélectricité est un signal biophysique qui fournit des conseils pour la croissance et la différenciation cellulaires au cours du développement embryonnaire et de la régénération tissulaire. La bioélectricité endogène existe dans le cytoplasme et l'espace extracellulaire, fournir aux scientifiques une ressource pour la stimulation électrique des cellules excitables et la régulation de l'activité cellulaire pour des applications biomédicales. La plupart des méthodes de traitement nécessitent une entrée d'énergie externe et une connexion filaire pour appliquer des impulsions électriques externes à travers des microdispositifs implantés. Les développements récents de la nanotechnologie ont permis des traitements sans électrode et sans batterie, qui incluent l'utilisation de nanogénérateurs pour la stimulation cérébrale, régénération des cheveux et cicatrisation des plaies. Cependant, la plupart d'entre eux nécessitent une solution bien acceptée pour stimuler électriquement les cellules fonctionnelles. Li et al. ont donc été inspirés par la fonction biologique et la microstructure des fibres de collagène dans la matrice extracellulaire pour former des bio-NG composés de fibres électrofilées piézoélectriques très discrètes pour fournir aux cellules un microenvironnement physiquement pertinent. L'interaction bio-NG-cellule s'applique aux environnements in vivo pour réduire l'inflammation, induire la prolifération des hépatocytes, et accélérer l'angiogenèse, ainsi que favoriser la réparation du foie.
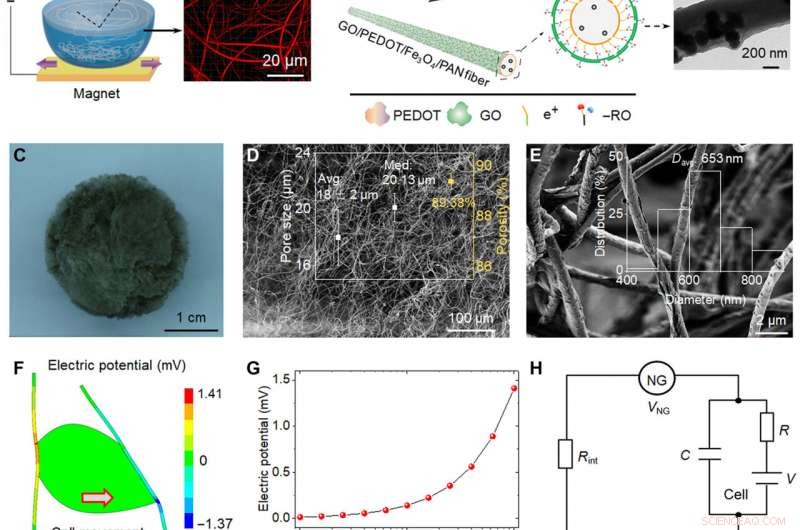
Représentation schématique et analyse piézoélectrique de bio-NGs. (A) Schéma de principe de la fabrication de fibres piézoélectriques très discrètes Fe3O4/PAN. Avec l'aide de l'aimant néodyme fer bore, Des nanoparticules magnétiques Fe3O4 ont été introduites dans une solution électrofilée PAN pour briser la tension superficielle de l'eau. (B) La couche conductrice PEDOT a été chargée avec la méthode de polymérisation in situ; Les nanofeuillets GO ont été adsorbés sur la couche la plus externe de fibres par la contribution de la force d'adsorption électrostatique pour former les fibres cibles GO/PEDOT/Fe3O4/PAN. Images de microscopie électronique à transmission de la fibre unique obtenues à chaque étape. (C à E) Image optique et images en microscopie électronique à balayage (MEB) des bio-NG. L'encart de (D) montre la distribution de la taille des pores et la porosité. L'encart de (E) montre la plage de distribution de diamètre de fibre des fibres GO/PEDOT/Fe3O4/PAN. (F) Simulation d'analyse par éléments finis de fibres piézoélectriques couplées à une cellule vivante générant une tension maximale de 141 mV lorsqu'elle est soumise à une force tangentielle de 10 nN. (G) Potentiel piézoélectrique généré par une seule fibre en fonction de la force cellulaire tangentielle appliquée. (H) Circuit résistance-condensateur simplifié créé par le NG, l'interface NG-cell, et la membrane cellulaire. (I) Images de phase de microscopie à force piézoélectrique (PFM) et d'amplitude PFM d'une seule fibre dans des bio-NG. (J) Hystérésis de potentiel électrique de phase et boucles d'amplitude papillon des fibres dans les bio-NG, obtenu avec une tension continue variant de -10 à 10 V. (K) Sorties de tension des bio-NG sous la même force d'impact de 1 N (bleu) et sous une vibration à 0,7 Hz (rouge). L'encart représentait les méthodes d'impact (à gauche) et de vibration (à droite) utilisées pour caractériser les fibres dans les bio-NG. F, Obliger. Crédit photo :Chuanmei Shi, Université des sciences et technologies de Nanjing. Crédit :Avancées scientifiques, 10.1126/sciadv.abh2350
Lors des expérimentations, l'équipe de recherche a introduit des nanoparticules magnétiques d'oxyde de fer dans du polyacrylonitrile pour préparer des fibres très discrètes à utiliser comme dispositif d'électrofilage à assistance magnétique. Pendant l'électrofilage, la configuration a permis la formation d'échafaudages avec des pores bien interconnectés et des fibres discrètes pour une migration sans cellules. Pour préparer un microenvironnement plus proche de l'in vivo, l'équipe a également transmis la bioélectricité en tant qu'indice biophysique. Pour y parvenir, les scientifiques ont développé un échafaudage cible pour favoriser l'interaction cellulaire et l'adhésion aux fibres. Le couplage électromécanique des bio-NG assemblés par l'échafaudage a favorisé la transmission et la communication de signaux entre les cellules pour imiter les effets bioélectriques des fibrilles ou fibres de collagène dans la matrice extracellulaire. L'équipe a simulé et étudié le potentiel piézoélectrique généré par la force cellulaire dans les bio-NG à l'aide d'une analyse par éléments finis. Pour y parvenir, ils ont appliqué une force de charge au contact cellule-fibre et ont d'abord mesuré la piézoélectricité d'une seule fibre dans les bio-NG en utilisant la microscopie à force piézoélectrique. Les signaux de tension expérimentaux ont validé la piézoélectricité théorique des bio-NG.
Caractériser les bio-NGs et réguler l'activité cellulaire
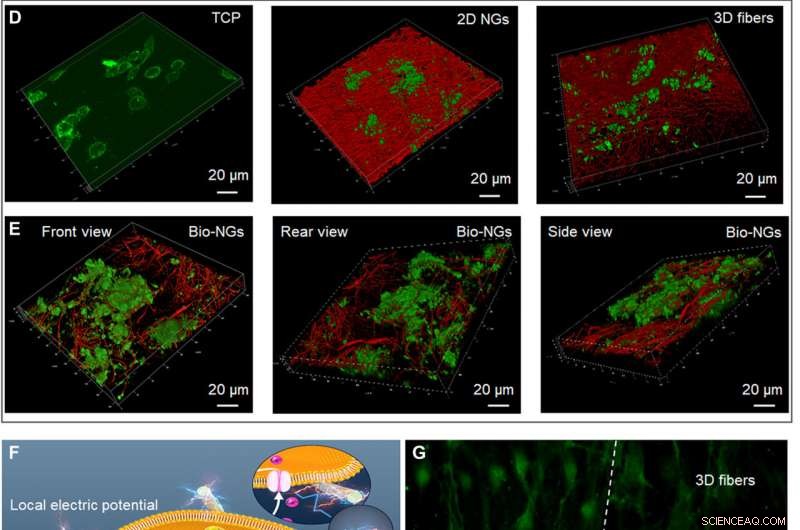
La croissance et le développement des neurones RGC5 dans les bio-NG. (A) Prolifération des neurones RGC5 par le dosage de l'ADN aux jours 1, 3, et 5. (B) Apoptose des neurones RGC5 après 5 jours de culture en bio-NG. (C) Excroissance des neurites des neurones RGC5 par la longueur médiane des neurites après 5 jours de culture dans des bio-NG. (D) Balayage confocal 3D de neurones RGC5 cultivés sur TCP, NG 2D, et fibres 3D. (E) Balayage confocal 3D de neurones RGC5 cultivés dans des bio-NG sous différents angles. (F) Force cellulaire inhérente des cellules vivantes cultivées dans des bio-NG. Cela induirait un champ électrique local proportionnel au niveau de contrainte qui pourrait éventuellement altérer le potentiel membranaire et/ou la configuration des récepteurs membranaires et entraînerait l'ouverture des canaux Ca2+. Ins3P, inositol triphosphate. API, phospholipase C. (G) Les images de fluorescence des cellules préincubées avec Fluo-4 AM (colorant perméable aux membranes et dépendant du Ca2+) sur les fibres en bio-NGs et fibres 3D. Vert, Ca2+. Toutes les barres d'erreur indiquent ±SD. Crédit :Avancées scientifiques, 10.1126/sciadv.abh2350
Pour étudier l'information des fibres dans les bio-NGs, l'équipe a utilisé les spectres infrarouges à transformée de Fourier (FTIR) et de diffraction des rayons X (XRD). Ils ont ensuite étudié les propriétés thermodynamiques des fibres piézoélectriques dans les bio-NG à l'aide de thermogrammes de calorimétrie différentielle à balayage (DSC) et ont mené des études de voltammogramme cyclique pour tester les propriétés de stockage et de transmission de charge des fibres piézoélectriques dans les bio-NG. L'équipe a ensuite testé la résilience à la compression et les propriétés mécaniques des fibres en formant d'abord des formes cylindriques et en comprimant les échafaudages pour comprendre l'excellente résilience des constructions. Les propriétés mécaniques et la résilience des fibres ont permis aux bio-NG de maintenir efficacement une taille de pores suffisamment grande et un microenvironnement de croissance 3D stable pour le mouvement et la croissance des cellules. L'équipe a également étudié l'interaction des cellules NG dans l'espace 3D avec deux lignées cellulaires différentes, notamment
la cellule ganglionnaire rétinienne 5 (RGC5) et les hépatocytes primaires. Les cellules contenaient des canaux calciques voltage-dépendants dans leurs membranes et d'autres étaient des cellules mobiles avec des fonctions métaboliques élevées. À l'aide de nanogénérateurs (NG) bidimensionnels et de fibres 3D non piézoélectriques, l'équipe a étudié les effets de l'espace 3D et de la stimulation électrique sur les cellules. Les données ont montré comment les bio-NG pourraient fournir un microenvironnement de culture cellulaire biocompatible pour d'autres expériences.
Promouvoir la réparation hépatique in vivo avec les bio-NG
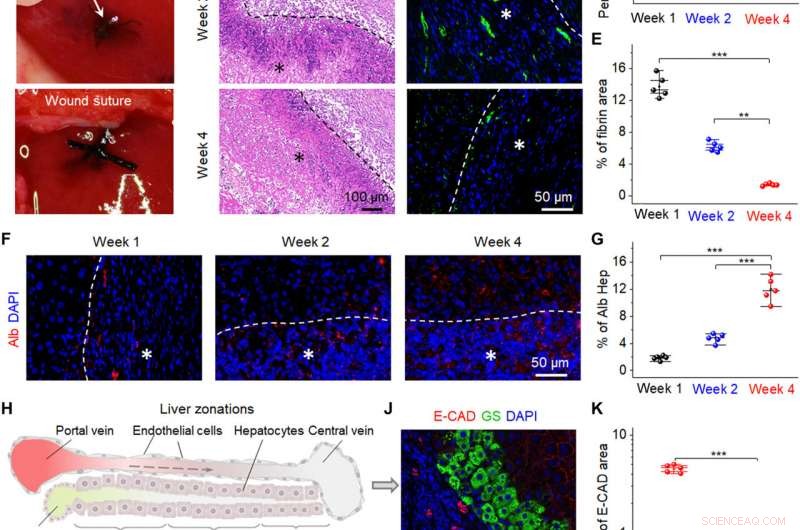
Promotion de la réparation hépatique par les bio-NG in vivo. (A) Images chirurgicales montrant l'implantation des bio-NG dans l'anomalie hépatique. (B) coloration H&E des coupes de foie à différents moments (semaines 1, 2, et 4) après implantation. (C) Images représentatives de l'immunocoloration de la fibrine hépatique (ogen) (vert) en 4′, Coupes de foie contre-colorées au 6-diamidino-2-phénylindole (DAPI) (bleu) au niveau de la zone implantée. (D) Pourcentage moyen de la zone positive mesurée à partir de la coloration H&E. (E) Quantification du marquage immunofluorescent de fibrine hépatique. (F) Immunomarquage pour Alb (rouge) sur des coupes de foie à différents moments (semaines 1, 2, et 4) après implantation. (G) Niveau d'expression d'Alb mesuré par immunocoloration d'Alb. (H) Schéma montrant trois zones hépatiques de la région périportale à la région péricentrale. 1, 2, et 3 indiquent la zone 1 (E-CAD+), zone 2 (E-CAD─GS─), et zone 3 (GS+), respectivement. La flèche en pointillé indique le flux sanguin. (I et J) Immunomarquage pour GS (vert) et E-CAD (rouge) sur des coupes de foie à la quatrième semaine après l'implantation. (K) Quantification de GS et E-CAD montrant une expression plus forte de la fonction hépatique des nouveaux hépatocytes dans les bio-NG que celle des fibres 3D. Hep, hépatocyte. Les astérisques (*) indiquent les emplacements de l'implantation. Les données sont exprimées en valeurs moyennes ± SD. n =5. **P <0,01 et ***P <0,001. Crédit photo :Fei Jin, Université des sciences et technologies de Nanjing. Crédit :Avancées scientifiques, 10.1126/sciadv.abh2350
Les scientifiques ont ensuite implanté les bio-NG dans une zone de lésion hépatique par rapport à la régénération des hépatocytes pour refléter leur aspect pratique. Pour y parvenir, ils ont utilisé des rats Sprague-Dawley pour induire des lésions hépatiques. Après quatre semaines d'implantation des bio-NG, l'équipe a retiré les implants et étudié l'inflammation à l'aide d'une coloration histologique. Ils ont noté une légère inflammation au cours de la première semaine, qui s'est amélioré au cours de la deuxième semaine et est revenu à des niveaux normaux au cours de la quatrième semaine. Tous les autres organes n'ont pas montré de déformation ou d'invasion anormale des cellules lymphatiques pour indiquer de bonnes conditions de santé sans effets secondaires systématiques. Le processus de régénération observé a mis en évidence un nouveau système de circulation sanguine qui s'est formé à l'intérieur du tissu hépatique régénéré pour suggérer l'interaction des bio-NG avec les cellules pour réduire l'inflammation et favoriser la réparation des tissus.
Stabilité à long terme et biocompatibilité des bio-NG in vivo
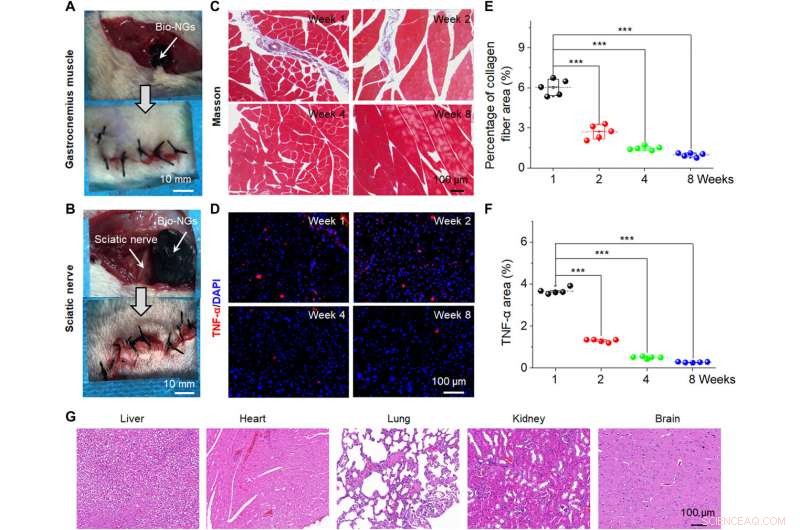
L'interaction des cellules NG a efficacement favorisé la viabilité cellulaire et maintenu son expression fonctionnelle in vitro et in vivo pour fournir une stratégie de traitement pour les essais cliniques. Pour la régénération des tissus, il est plus efficace de transplanter directement des cellules fonctionnelles dans le site endommagé in vivo. Pour des études complémentaires, l'équipe a implanté les bio-NG dans la zone du muscle gastrocnémien autour du nerf sciatique de rats pour détecter la stabilité des bio-NG in vivo. Li et al. puis retiré les implants après huit semaines et analysé l'inflammation pour montrer une bonne biocompatibilité des bio-NG pendant des périodes prolongées dans des environnements biologiques sans aucun effet secondaire systémique. Les constructions sont prometteuses en tant qu'implants pour la réparation régénérative in vivo.
Stabilité et biocompatibilité in vivo des bio-NG. Image chirurgicale montrant l'implantation des bio-NGs dans (A) le muscle gastrocnémien et (B) les zones du nerf sciatique d'une souris. (C) Coloration au trichrome de Masson des muscles gastrocnémiens dans la zone implantée. (D) Coloration immunofluorescente au TNF-α du nerf sciatique au niveau de la zone implantée. (E) Pourcentage moyen de fibres de collagène dans le tissu musculaire mesuré par coloration de Masson. (F) Niveau d'expression relatif du TNF-α mesuré à partir de la coloration immunofluorescente du TNF-α. (G) coloration H&E des organes vitaux (foie, cœur, poumon, un rein, et cerveau) à la semaine 8 après l'implantation dans la région du nerf sciatique. Les données sont exprimées en valeurs moyennes ± SD. n =5. ***P <0,001. Crédit photo :Tong Li, Université des sciences et technologies de Nanjing. Crédit :Avancées scientifiques, 10.1126/sciadv.abh2350
De cette façon, Tong Li and colleagues developed extracellular matrix-like electromechanical coupling bio-nanogenerators (bio-NGs) to regulate cell activity and maintain its specific functional expression. The product created a local voltage potential to stimulate living cells as long as they remained motile. The unique environment facilitated cell culture in bio-NGs to trigger the opening of ion channels present in the cellular plasma membrane to achieve electrical stimulation at the single-cell level. The process offers great potential for bioelectronic medicine and cell-targeted local electrical impulses. The new method can replace inaccurate 2D systems and time-consuming animal models to provide a biomimetic, physiological microenvironment for accelerated tissue regeneration and bioinspired electronic medicine.
© 2021 Réseau Science X