
L'eau est différente des autres substances car sa forme solide - comme cet iceberg - est moins dense que sa forme liquide - comme cet océan. Les scientifiques étudient d'autres propriétés étranges de l'eau. Crédit :Wikimedia Commons
L'eau a de nombreuses propriétés inhabituelles, comme sa forme solide, la glace, être capable de flotter dans l'eau liquide, et ils deviennent plus étranges en dessous de son point de congélation. L'eau surfondue - en dessous de zéro mais toujours liquide - est notoirement difficile à étudier. Certains chercheurs pensaient que l'eau surfondue se comportait étrangement dans une plage particulièrement froide, passer d'un liquide à un solide, cristallisant instantanément à une température particulière comme dans un roman de Kurt Vonnegut.
Maintenant, les chercheurs ont trouvé un moyen de prendre des instantanés de l'eau gelée dans cette plage de surfusion profonde. Et devine quoi? L'eau n'est pas aussi étrange qu'elle pourrait l'être. L'eau liquide peut exister tout en bas, cristalliser en un solide plus lentement à mesure que les choses se refroidissent - comme prévu, mais jamais tout d'un coup.
Une équipe de chercheurs du Pacific Northwest National Laboratory du ministère de l'Énergie a rapporté les travaux dans le Actes de l'Académie nationale des sciences Première édition en ligne. Bien que les résultats ne changeront pas la façon dont vous préparez votre thé glacé en été, cela pourrait aider les théoriciens à étoffer leur compréhension de l'eau et aider les scientifiques atmosphériques à mieux comprendre la pluie et les nuages.
Un truc d'eau bizarre
La plupart des gens savent que la glace flotte sur l'eau liquide, mais ils ne savent peut-être pas que l'eau a du mal à former un verre. Un verre, comme une fenêtre, est un solide dans lequel les molécules sont en fait disposées comme elles le seraient dans un liquide.
Prenez un bouquet d'oranges. Les oranges éparpillées dans un sac sont comme un liquide - les molécules individuelles peuvent se déplacer assez librement. Si vous emballez soigneusement les oranges dans une boîte, vous formez un cristal. Si vous serrez le sac et empêchez les oranges en désordre de se déplacer mais sans les ranger soigneusement, vous formez un verre.
Les verres sont parfaits car ils peuvent contenir des contaminants - pensez à une mouche dans l'ambre, ou des déchets nucléaires dans du verre vitrifié – alors que les cristaux éliminent les contaminants – la congélation de l'eau de mer est un moyen de la dessaler. Pour faire un verre, les chercheurs font fondre du sable ou un autre composant jusqu'à ce qu'il soit liquide. Et puis ils le refroidissent si vite qu'il ne peut pas former de cristal avant qu'il ne se solidifie.
Mais congelez l'eau en vrac rapidement et elle ne forme pas de verre. Il devient rapidement de la glace. Pour devenir verre, l'eau liquide doit être refroidie à une température profondément inférieure à zéro en quelques microsecondes - environ 136 Kelvin (environ moins 215 degrés F), une température commune dans l'espace extra-atmosphérique, où certains s'attendent à ce que l'eau vitreuse existe.
La plage qui a été difficile à étudier est légèrement supérieure à cette température dite de transition vitreuse. Les scientifiques ne savent pas ce qui se passe entre environ 160 et 235 K. (Dans la vraie vie, c'est entre la température sur la lune de Mars Phobos et Fairbanks, Alaska, au cœur de l'hiver.) À l'extrémité supérieure de cette plage (plus près de 235 K, Fairbanks), l'eau gèle d'un liquide surfondu en un cristal en quelques millisecondes, ce qui est beaucoup trop rapide pour les techniques analytiques actuelles à étudier.
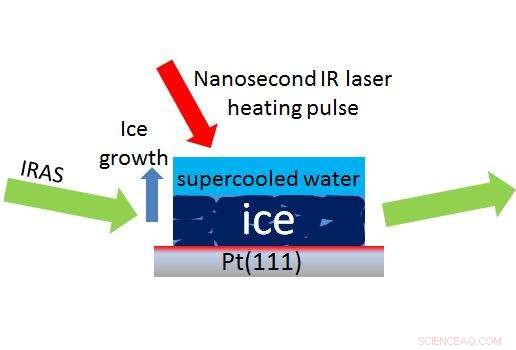
Un laser (flèche rouge) crée une minuscule goutte d'eau surfondue au-dessus de la glace, permettant aux scientifiques d'utiliser une méthode appelée IRAS (flèches vertes) pour mesurer en nanosecondes à quelle vitesse l'eau surfondue se transforme en glace. Crédit :Kay, Kimmel/PNNL
Les scientifiques ont proposé une variété d'idées pour expliquer ce qui pourrait se passer dans cette région inexplorée. Ils se sont demandé si l'eau resterait métastable – liquide mais prête à commencer à cristalliser à tout moment – jusqu'à des températures où elle deviendrait un verre. Ou si le liquide devenait instable quelque part plus chaud que cela, autour de 228 K (un peu plus chaud que les minimums records de la station McMurdo en Antarctique), à quel point il se cristalliserait spontanément en raison de ce que les physiciens appellent une singularité. Aussi, quelque chose dans cette plage pourrait se produire qui peut aider à expliquer pourquoi l'eau a du mal à former un verre.
"Il y avait pléthore de postulats mais peu de données, " a déclaré Bruce Kay, physicien chimiste du PNNL.
"Notre objectif était de développer une nouvelle technique pour chauffer et refroidir rapidement des films d'eau surfondus à l'échelle nanométrique, " a déclaré le physicien du PNNL Greg Kimmel.
Le mystère à l'intérieur
Pour obtenir les données dans cette plage non mesurable, Kimmel et Kay ont travaillé avec Yuntao Xu, un expert laser, et d'autres au PNNL et ont développé un moyen de chauffer et de refroidir l'eau à l'échelle de la nanoseconde avec un laser. En utilisant cette méthode, les scientifiques du PNNL ont mesuré à quelle vitesse l'eau surfondue se transformait en glace cristalline lorsque la température diminuait. Le temps de cristallisation est passé de nanosecondes près des températures les plus élevées à des heures à 126 K. À aucun moment, surtout à 228 K, l'eau surfondue s'est-elle cassée en cristal, exclure la possibilité d'une singularité.
Chercher la singularité sous un autre angle, les chercheurs ont exploré à quelle vitesse les molécules d'eau surfondue pouvaient se déplacer, et combien cela a changé à mesure qu'il faisait plus froid. Si la singularité existait, ils s'attendraient à ce que les molécules d'eau soient incapables de se déplacer à un moment donné. Du point de congélation au point de verre, les molécules se déplaçaient de plus en plus lentement d'une manière complexe mais continue. Globalement, la relation entre la température et la vitesse à laquelle les molécules pouvaient se déplacer ne suggérait pas une singularité à 228 K.
"Nous pouvons probablement retirer la singularité de la table, " a déclaré Kay de PNNL.
Pris ensemble, les résultats fournissent des informations précieuses sur le comportement de l'eau.
"Par exemple, en chimie atmosphérique, des gouttes d'eau surfondues se trouvent dans les nuages. Il y a des questions sur combien de temps ils persistent, " a déclaré Kimmel du PNNL.